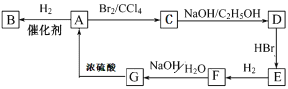
-
我国古代文献中有许多化学知识的记载,如《梦溪笔谈》中的“信州铅山县有苦泉,……,挹其水熬之,则成胆矾,熬胆矾铁釜,久之亦化为铜”等,上述描述中没有涉及的化学反应类型是
A. 复分解反应 B. 化合反应
C. 离子反应 D. 氧化还原反应
难度: 中等查看答案及解析
-
化学与生产、生活密切相关,下列说法错误的是
A. 液化石油气主要含乙烯、丙烯和甲烷
B. 限制氟利昂的使用是为了保护大气臭氧层
C. 在船身适当位置装锌块可以避免船体遭受腐蚀
D. 工业上冶炼像钠、钙、镁、铝这样的活泼金属,需采用电解法
难度: 简单查看答案及解析
-
水溶液中下列表达式正确的是( )
A. H2SO3的电离:H2SO3
2H++SO32-
B. NaHSO3的水解:HSO3-+H2O
H3O++SO32-
C. NaHS的水【解析】
HS-+H2OH2S+OH-
D. BaSO4溶液中存在平衡:BaSO4
Ba2++SO42-
难度: 中等查看答案及解析
-
氢氟酸是弱酸,电离方程式为HFH++F-,达到电离平衡的标志是
A. c(H+)=c(F-)
B. v(HF分子电离)=v(形成HF分子)
C. 溶液显酸性
D. 单位时间内,电离的HF分子数与生成的F-数相等
难度: 简单查看答案及解析
-
观察下列几个装置示意图,有关叙述正确的是
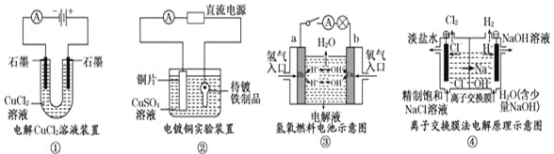
A. 装置①中阳极上析出红色固体
B. 装置②的待镀铁制品应与电源正极相连
C. 装置③中外电路电子由a极流向b极
D. 装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
难度: 困难查看答案及解析
-
能证明乙酸是弱酸的实验事实是
A. CH3COOH溶液与Zn反应放出H2
B. 0.1 mol/L CH3COONa溶液的pH大于7
C. CH3COOH溶液与Na2CO3反应生成CO2
D. 0.1 mol/L CH3COOH溶液可使紫色石蕊变红
难度: 中等查看答案及解析
-
下列各组中的两种物质属于同系物的是( )
A. CH3CH2CH2OH与CH3OH B.
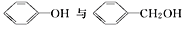
C. CH3COOH与HCOOCH3 D. CH3CH2Cl与CH3CH2CH2Br
难度: 简单查看答案及解析
-
在氨水中存在电离平衡:NH3·H2O
NH4++OH-,下列情况能引起电离平衡向右移动的有( )
①加NH4Cl固体 ②加NaOH溶液 ③通HCl ④加CH3COOH溶液 ⑤加水
A. ①③⑤ B. ①④⑤ C. ③④⑤ D. ①②④
难度: 中等查看答案及解析
-
有机物CH3—CH=CH—Cl能发生的反应: ①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使酸性KMnO4溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦加聚反应。下列说法正确的是( )
A. 以上反应均可发生 B. 只有⑦不能发生 C. 只有⑥不能发生 D. 只有②不能发生
难度: 简单查看答案及解析
-
把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则酸和碱的体积比应是( )
A. 10∶1 B. 1∶10
C. 1∶100 D. 1∶2
难度: 中等查看答案及解析
-
25℃时,下列溶液等体积混合后,溶液pH>7的是
A. pH=3的H2SO4和pH=11的氨水
B. 0.1 mol/L的盐酸和0.2 mol/L的醋酸钠溶液
C. 等物质的量浓度的盐酸和氨水
D. 等物质的量浓度的硫酸和NaOH溶液
难度: 中等查看答案及解析
-
制备异戊二烯流程如下图所示。下列说法不正确的是( )
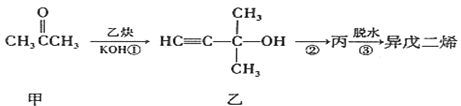
A. 甲分子中只有1种化学环境的氢原子 B. 乙能发生加成反应、取代反应、消去反应
C. 丙分子中的官能团有碳碳双键和羟基 D. 上述每步转化都属于消去反应
难度: 困难查看答案及解析
-
通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
难度: 中等查看答案及解析
-
t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是
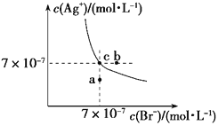
A. 在t ℃时,AgBr的Ksp为4.9×10-13
B. 通过蒸发,可使溶液由a点变到c点
C. 图中b点有AgBr沉淀析出
D. 在t ℃时,AgCl(s)+Br-(aq)
AgBr(s)+Cl-(aq)的平衡常数K≈816
难度: 中等查看答案及解析
-
某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是( )
A. 放电时,Li+在电解质中由负极向正极迁移
B. 放电时,负极的电极反应式为LixC6-xe-= xLi++ C6
C. 充电时,若转移1mol e-,石墨C6电极将增重72g
D. 充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+ xLi+
难度: 中等查看答案及解析
-
下列化合物中,既能发生消去反应生成烯烃,又能发生水解反应的是( )
A. CH3CH2OH B.
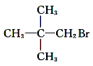
C.
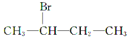 D.
D. 难度: 简单查看答案及解析
-
烯烃、一氧化碳和氢气在催化剂作用下生成醛的反应,成为羰基合成,也叫烯烃的醛化反应。由乙烯制丙醛的反应为CH2=CH2+CO+H2→ CH3CH2CHO.由化学式为C4H8的烯烃进行醛化反应,得到醛的同分异构体可能有( )
A. 2种 B. 3种 C. 4种 D. 5种
难度: 中等查看答案及解析
-
用惰性电极电解法制备硼酸[H3BO3或B(OH) 3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是( )
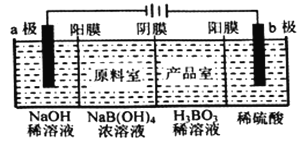
A. 阴极与阳极产生的气体体积比为1:2
B. b极的电极反应式为2H2O-2eˉ=O2↑+4H+
C. 产品室中发生的反应是B(OH)3+OHˉ=B(OH)4ˉ
D. 每增加1 mol H3BO3产品,NaOH溶液增重22g
难度: 困难查看答案及解析
-
设阿伏加德罗常数的值为NA,下列说法中正确的是( )
A. 1 mol 苯乙烯中含有的C=C数为4 NA
B. 2.8 g 乙烯和环己烷的混合气体中所含碳原子数为0.2 NA
C. 0.1 mol CnH2n+2中含有的C—C键数为0.1n NA
D. 标准状况下,2.24 L CCl4含有的分子数为0.1 NA
难度: 简单查看答案及解析
-
在下列溶液中,一定能大量共存的离子组是
A.常温下
=1012的溶液中:Fe2+、Mg2+、NO3-、Cl-
B.含有大量Al3+的溶液中:SO42-、S2-、AlO2-、ClO-、
C.能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br-
D.常温下,在由水电离出的c(H+)=1×10-13 mol·L-1的溶液中:K+、Fe3+ 、Cl-、SO42-
难度: 中等查看答案及解析
-
有一混和液可能由NaOH、NaHCO3、Na2CO3中的一种或两种组成.现取等体积的两份上述溶液分别以酚酞和甲基橙为指示剂,用同样浓度的盐酸进行滴定,当达到滴定终点时,消耗盐酸的体积分别为V1 mL和V2 mL,如,V1<V2<2V1,则上述溶液中的溶质是( )
A. NaHCO3 B. Na2CO3 C. NaHCO3、Na2CO3 D. Na2CO3、NaOH
难度: 困难查看答案及解析
-
已知:25℃,NH3·H2O电离平衡常数K=1.76×10-5。25℃,向1 L 0.1 mol/L某一元酸HR溶液中逐渐通入氨气,若溶液温度和体积保持不变,所得混合溶液的pH与
变化的关系如图所示。下列叙述正确的是

A. 由图可推知:25℃,0.1 mol/L NaR溶液的pH约为10
B. 当通入0.1 mol NH3时,所得溶液中:c(NH4+)>c(R-)>c(OH-)>c(H+)
C. pH=7时,所得溶液中:c(HR)>c(R-) =c(NH4+)
D. pH=10时,所得溶液中:c(R-)>c(HR) ,c(NH4+)>c(NH3·H2O)
难度: 困难查看答案及解析
 的系统命名为___________________;
的系统命名为___________________;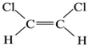 和
和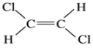 两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是(_______)
两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是(_______)