-
某高校老师要求学生配制0.1 mol/L的KMnO4溶液100mL。完成下列实验。
(实验一)研究温度对反应速率的影响,学生取两只试管,均加入4mL 0.1 mol/L的KMnO4酸性溶液和10mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。写出此反应的离子方程式: 。
(实验二)测定某乙二酸溶液的浓度,具体操作为:
(1)滴定:准确量取25.00 mL乙二酸溶液于锥形瓶中,加少量酸酸化,将KMnO4溶液装入________(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。
请解释原因: 。待到 ,证明达到滴定终点。
(2)计算:再重复上述操作2次,记录实验数据如下。
序号
滴定前读数(mL)
滴定后读数(mL)
1
0.00
20.10
2
1.00
20.90
3
0.00
22.10
则此乙二酸溶液的浓度为 。
(3) 误差下列操作会导致乙二酸溶液浓度偏高的是 。
A. 配制KMnO4溶液定容时,仰视观察刻度线
B.未用待测液乙二酸润洗滴定管
C.滴定前锥形瓶有少量水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.滴定时振荡锥形瓶有溶液飞溅出去
F.观察读数时,滴定前仰视,滴定后俯视
高二化学实验题中等难度题查看答案及解析
-
(16分)
(1)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中, B试管置于冷水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。
②写出该反应的离子方程式 。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: ;当 ,证明达到滴定终点。
③计算: 重复上述操作2次,记录实验数据如下表。则消耗KMnO4溶液的平均体积为 mL,此样品的纯度为 。(已知H2C2O4的相对分子质量为90)

④误差分析:下列操作会导致测定结果偏高的是 。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管 B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视
高二化学填空题中等难度题查看答案及解析
-
某同学进行影响草酸溶液与高锰酸钾酸性溶液反应速率因素的研究。室温下,实验数据如下:
实验序号
①
②
③
加入试剂
4mL 0.01mol/L KMnO4
2mL 0.1mol/L H2C2O4
4mL 0.01mol/L KMnO4
2mL 0.1mol/L H2C2O4
少量MnSO4固体
4mL 0.01mol/L KMnO4
2mL 0.1mol/L H2C2O4
少量Na2SO4固体
褪色时间/s
116
6
117
(1)草酸溶液与高锰酸钾酸性溶液反应的离子方程式为___________________。
(2)该实验结论是_______________________。
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请写出实验①的现象为____________________。
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是_________________。
(5)该同学拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。
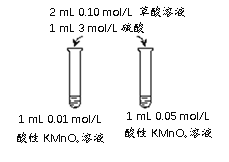
a.该同学拟研究的影响因素是___________________。
b.你认为该同学的实验方案_______________(填“合理”或“不合理”),理由是____________________________。
高二化学实验题困难题查看答案及解析
-
Ⅰ.某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
实验
编号
0.01 mol·L-1酸性KMnO4溶液
0.1 mol·L-1
H2C2O4溶液
水
反应温度/℃
反应时间/s
①
5.0mL
5.0mL
0
20
125
②
V1
V2
2.0mL
20
320
③
5.0mL
5.0mL
0
50
30
反应方程式为:2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2↑+ 8H2O
(1)实验的记时方法是从溶液混合开始记时,至_________________时,记时结束。
(2)实验①和②研究浓度对反应速率的影响,则V1=______mL , V2=_______mL。
(3)下列有关该实验的叙述正确的是_________。
A.实验时必须用移液管或滴定管来量取液体的体积
B.实验时应将5.0 mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数。
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(4)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是__________;
Ⅱ. 某草酸晶体的化学式可表示为H2C2O4 • xH2O,为测定x的值,进行下列实验:
①称取7.56g某草酸晶体配成100.0mL的水溶液,
②用移液管移取25. 00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.600mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL。
(1)若滴定终点时仰视读数,则所测x的值将 _____(填“偏大”或“偏小”)。
(2)x=_________。
高二化学实验题困难题查看答案及解析
-
Ⅰ某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
实验
编号
0.01 mol·L-1酸性KMnO4溶液
0.1 mol·L-1
H2C2O4溶液
水
反应温度/℃
反应时间/s
①
5.0mL
5.0mL
0
20
125
②
V1
V2
2.0mL
20
320
③
5.0mL
5.0mL
0
50
30
反应方程式为:2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10CO2↑+ 8H2O
(1)实验的记时方法是从溶液混合开始记时,至 时,记时结束。
(2)实验①和②研究浓度对反应速率的影响,则V1= mL , V2= mL。
(3)下列有关该实验的叙述正确的是 。
A.实验时必须用移液管或滴定管来量取液体的体积
B.实验时应将5.0 mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数。
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(4)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是 ;
Ⅱ某草酸晶体的化学式可表示为H2C2O4 • xH2O,为测定x的值,进行下列实验:
①称取7.56g某草酸晶体配成100.0mL的水溶液,
②用移液管移取25. 00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.600mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL。
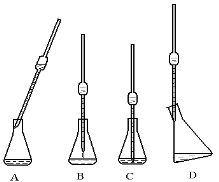
(1)移取所配溶液25.00 mL于锥形瓶中,操作如图所示(手持部分省略):正确的操作是图 。
(2)x= 。
高二化学实验题困难题查看答案及解析
-
乙二酸(H2C2O4)俗名草酸,是一种有还原性的有机二元弱酸。
(1)一同学在做“研究温度对化学反应速率的影响”实验时,他往a、b两支试管中均加入5.0mL 0.01mol▪L-1的酸性KMnO4溶液和2.0mL 0.1mol▪L-1H2C2O4溶液,振荡,a试管置于热水中,b试管置于冷水中,记录溶液褪色所需的时间。
①褪色所需时间ta________(填“>”“=”或“<”)tb;
②写出该反应的离子方程式:__________________________________。
(2)配制250mL乙二酸溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
①滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol▪L-1 KMnO4标准溶液装入________(填“酸式”或“碱式”)滴定管,进行滴定操作;
②判断滴定达到终点的现象是____________________________________________。
③这位同学共重复滴定操作了3次,记录实验数据如下表:
序号
滴定前读数/mL
滴定后读数/mL
1
0.50
20.51
2
1.50
21.49
3
0.32
21.85
则这位同学计算得到此样品的纯度为_________。
高二化学实验题中等难度题查看答案及解析
-
为了研究影响化学反应速率的因素,甲、乙、丙、丁四位学生分别设计了如下四个实验,你认为不正确的是
A.100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
B.将相同大小、形状的铝条与稀硫酸和浓硫酸反应时,稀硫酸产生氢气快
C.将氢气和氯气的混合气体分别放在冷暗处和强光照射下,会发现光照下有氯化氢生成
D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管再加入少量二氧化锰,产生氧气的快慢不同
高二化学单选题中等难度题查看答案及解析
-
为了研究影响化学反应速率的因素,甲、乙、丙、丁四位学生分别设计了如下四个实验,你认为不正确的是
A.100 mL 2 mol·L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
B.将相同大小、形状的铝条与稀硫酸和浓硫酸反应时,稀硫酸产生氢气快
C.将氢气和氯气的混合气体分别放在冷暗处和强光照射下,会发现光照下有氯化氢生成
D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管再加入少量二氧化锰,产生氧气的快慢不同
高二化学选择题中等难度题查看答案及解析
-
以下实验设计能达到实验目的是
实验目的
实验设计
A
探究浓度对反应速率的影响
盛有4mL1mol/L KMnO4酸性溶液的两支试管,一支加入2 mL 0.1mol/LH2C2O4溶液,另一支加入2mL0.2 mol/L H2C2O4溶液
B
制备无水AlCl3
蒸发Al与稀盐酸反应后的溶液
C
重结晶提纯苯甲酸
将粗品水溶、过滤、蒸发、结晶
D
比较铜和镁的金属活动性强弱
用石墨电极电解Mg(NO3)2、Cu(NO3)2的混合液
A. A B. B C. C D. D
高二化学单选题中等难度题查看答案及解析
-
某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如下:
实验序号
A 溶液
B 溶液
①
20 mL 0.1 mol•L-1 H2C2O4 溶液
30 mL 0.01 mol•L-1 KMnO4 酸性溶液
②
20 mL 0.2 mol•L-1 H2C2O4 溶液
30 mL 0.01 mol•L-1 KMnO4 酸性溶液

(1)检验上图装置气密性的最简便方法为:____________。
(2)H2C2O4溶液与酸性 KMnO4溶液反应的化学方程式为____________。
(3)该实验探究的是___________因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是___________(填实验序号)。
(4)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________(若忽略溶液混合前后体积的变化)。
(5)小组同学发现反应速率总是如上右图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①__________、②_________、③K+对该反应有催化作用。
高二化学实验题困难题查看答案及解析