-
下表是25℃时三种弱酸的电离平衡常数:
| 化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
| Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因____________________。
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为____________。
(3)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为________________,解释混合溶液呈碱性的原因_________________________________。
(4)写出NaA溶液中通少量CO2的离子方程式_______________________________________。
(5)某同学用Na2CO3和NaHCO3溶液进行如下图所示实验:

① 充分反应后a试管中大量存在的离子是_______________________________________。
② 用离子方程式表示b试管中发生的反应_______________________________________。
-
下表为25℃的三种弱酸的电离平衡常数:
| 化学式 | HA(A代表某种酸根) | HNO2 | H2CO3 |
| Ka | Ka=4.9×10-10 | Ka=4.6×10-4 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因_________________________。
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为_______________。
(3)写出NaA溶液中通少量CO2的离子方程式____________________。
(4)现有Na2CO3和NaHCO3两种白色固体物质,欲探究Na2CO3和NaHCO3稳定性的相对强弱,设计了以下实验:
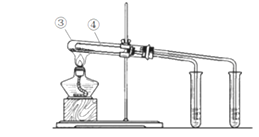
①如上图所示,试管④中装入的固体应该是_________(填化学式)。
②通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性更_______(填“强”或“弱”)。
-
已知 25℃ 时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
则下列说法正确的是 ( )
A.等物质的量浓度的各溶液 pH 关系为:pH ( NaCN)>pH(Na2CO3)>pH( CH3COONa)
B.浓度均为0.2mol/LNaHCO3和 Na2CO3溶液中,存在的粒子种类不相同
C.0.4 mol·L-1HCN 溶液与 0.2 mol·L-1NaOH 溶液等体积混合后,所得溶液中:c(Na+)>c(OH-)>c(H+)
D.25℃ 时,pH=4且浓度均为0.1 mol·L-1的 CH3COOH、CH3COONa混合溶液中:
c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH)
-
25℃时,三种弱酸的电离平衡常数如下表所示,下列说法正确的是
| 化学式 | CH3COOH | HCN | H2CO3 |
| 平衡常数 | Ka=1.8×10-5 | Ka=4.9×10-10 | Ka1=1.8×10-7 Ka2=5.6×10-11 |
A.25℃,等体积、等物质的量浓度的溶液中水的电离程度大小:CH3COOH>H2CO3>HCN>HCO3-
B.将2a mol/L HCN溶液与a mol/L NaOH溶液等体积混合,混合液中:c(H+)<c(OH-)
C.物质的量浓度之比为1:2的Na2CO3、NaHCO3混合溶液中:4c(Na+)= 3[c(HCO3-)+c(CO32-)+c(H2CO3)]
D.等体积、等pH的CH3COOH溶液、HCN溶液稀释相同倍数后,溶液的浓度:c(CH3COOH)>c(HCN)
-
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
在25℃时,下列选项不正确的是
A.反应CN-+H2O+CO2=HCN+HCO3-能够发生
B.中和等体积、等pH的HCOOH和HCN消耗NaOH的量,前者小于后者
C.物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-)
D.c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
-
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列选项正确的是( )
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)>c(K+)-c(CN-)
D. 浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>①
-
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列选项正确的是( )
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)>c(K+)-c(CN-)
D. 浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>①
-
已知25℃时,有关弱酸的电离平衡常数:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
则下列有关说法不正确的是
A.25℃时,0.1mol·L-1溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
C.25℃时,同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
-
已知25℃时,有关弱酸的电离平衡常数:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
则下列有关说法不正确的是
A.25℃时,0.1mol·L-1溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
C.25℃时,同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
-
部分弱酸的电离平衡常数数据如下表,则下列选项正确的是( )
| 弱电解质 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7Ka2=5.6×10-11 |
A. 向NaCN溶液中通入CO2发生反应:2CN-+H2O+CO2=2HCN+CO32-
B. 相同物质的量浓度的HCOONa、NaCN、Na2CO3溶液,pH值大小为:NaCN>Na2CO3>HCOONa
C. 等体积等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
D. 中和等体积、等pH的HCOOH和HCN,消耗NaOH的物质的量前者大于后者

