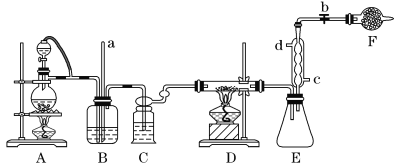
-
下列说法中正确的是
A. 第ⅦA族单质从上往下熔沸点逐渐升高,第ⅠA族单质从上往下熔沸点逐渐降低
B. Na2SiO3溶液可用作矿物胶、木材防火剂,还可用作制备硅胶的原料
C. 品红溶液和滴有酚酞的NaOH溶液均能与SO2气体作用而褪色,且其实质相同
D. 镁和铝性质稳定且都有很强的抗腐蚀能力,所以镁铝合金可用于飞机、轮船制造
难度: 简单查看答案及解析
-
下列方程式正确的是
A. Fe2(SO4)3溶液和足量Zn充分反应:2Fe3++Zn═2Fe2++Zn2+
B. NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO
C. 氢氧化铁与HI溶液反应的离子方程式为Fe(OH)3+3H+═Fe3++3H2O
D. 氧化铁溶于稀硝酸的离子方程式为Fe2O3+6H+═2Fe3++3H2O
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. 二氧化硅分子由1个硅原子和2个氧原子构成
B. 用加热的方法可将氯化铵固体中混有的少量碘除去
C. 陶瓷、玻璃、水泥容器都能贮存氢氟酸
D. 玻璃窑中出来的气体的主要成分是二氧化碳
难度: 简单查看答案及解析
-
下列物质与其用途相符合的是
①Cl2——自来水消毒剂 ②浓硫酸——干燥剂 ③AgI——人工降雨
④FeCl3——印刷电路板 ⑤淀粉——检验I2的存在 ⑥Na2O2——漂白纺织物
A. ②③④⑤⑥ B. ①②③④⑤ C. ②③④⑤ D. 全部
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 足量的Fe在Cl2中燃烧只生成FeCl3
B. 铁的化学性质比较活泼,它能和水蒸气反应生成H2和Fe(OH)3
C. 用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2
D. 向某溶液中加NaOH溶液得白色沉淀,且颜色逐渐变为红褐色,说明该溶液只含Fe2+
难度: 中等查看答案及解析
-
海水是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。卤素单质及化合物在许多性质上都存在着相似性和递变性。下列有关说法正确的是
A. 卤化银AgF、AgCl、AgBr、AgI都难溶于水
B. 卤化氢的键能按H-F、H-Cl、H-Br、H-I的顺序依次减小
C. 卤化氢水溶液的酸性按HF、HCl、HBr、HI的顺序依次减弱
D. 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
难度: 中等查看答案及解析
-
用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中对应选项错误的是
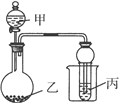
甲
乙
丙
试管中的现象
A
浓硫酸
亚硫酸钠
石蕊试液
先变红后褪色
B
醋酸
粉状贝壳
Na2SiO3溶液
浑浊
C
浓氨水
生石灰
AgNO3溶液
先沉淀后溶解
D
浓硝酸
铜
水
生成无色气体并在试管口变为红棕色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间。下列有关反应的化学方程式不正确的是
A. (CN)2+H2===2HCN
B. MnO2+4HCN
Mn(CN)2+(CN)2↑+2H2O
C. 将(CN)2通入水中:(CN)2+H2O ===HCN+ HCNO
D. 在NaI和KCN混合液中通入少量Cl2:Cl2+2KCN===2KCl+(CN)2
难度: 中等查看答案及解析
-
用1L1mol·L-1NaOH溶液吸收0.8molCO2,所得溶液中Na2CO3和NaHCO3的物质的量之比约为
A. 1︰2 B. 1︰3 C. 2︰3 D. 3︰2
难度: 中等查看答案及解析
-
室温下,0.1mol/L的Na2CO3溶液中,下列粒子浓度关系式不正确的是
A. c(Na+)= 2[c(CO32-)+ c(HCO3-)+ c(H2CO3)]
B. c(Na+)+ c(H+)= 2c(CO32-)+ c(HCO3-)+ c(OH—)
C. c(H+)= c(OH-)—c(HCO3-)—c(H2CO3)
D. c(Na+)>c(CO32-)> c(OH—)> c(HCO3-)> c(H+)
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 常温下,将pH =10的氨水稀释,溶液中所有离子浓度都减小
B. 常温下,反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
C. 用NaOH标准溶液滴定未知浓度的CH3COOH溶液时,使用甲基橙作指示剂
D. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
难度: 中等查看答案及解析
-
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A. 定性检验SO32-,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用硫酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D. 检验溶液中是否含有SO42-时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加Ba(NO3)2溶液
难度: 中等查看答案及解析
-
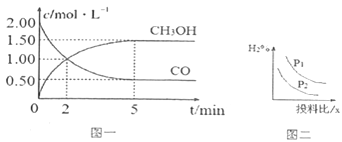
在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
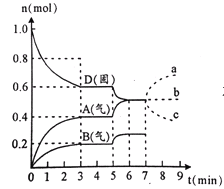
A. 从反应开始到第一次达到平衡时, A物质的平均反应速率为0.0667 mol/(L·min)
B. 该反应的化学方程式为2D(s) 2A(g)+B(g),该反应的平衡常数表达式为K=c(A)2·c(B)
C. 已知:反应的∆H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
难度: 中等查看答案及解析
-
下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用Li-CO2电池,组成为:钌电极/CO2饱和的LiClO4-DMSO电解液/锂片。下列说法不正确的是
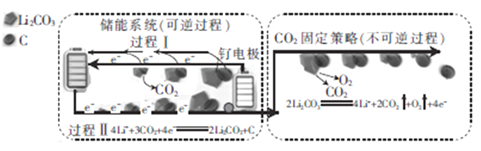
A. Li-CO2电池的电解液由LiClO4和DMSO溶于水得到
B. CO2的固定中,每转移8 mol e-,生成6 mol气体
C. 过程Ⅱ中化学能转化为电能
D. 过程Ⅰ的钌电极的电极反应式为2Li2CO3+C-4e-═4Li++3CO2↑
难度: 中等查看答案及解析
-
某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4
 LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MHM+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
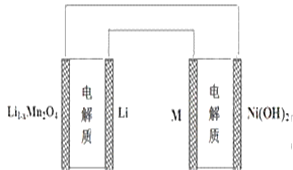
A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极电极反应式:NiOOH+H2O +e-==Ni(OH)2+OH-
C. 上图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式: LiMn2O4—xe-== Li1-xMn2O4+ xLi+
难度: 中等查看答案及解析
-
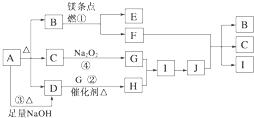
已知A是一种常见的非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,上述物质间的转化关系如图所示,下列说法错误的是
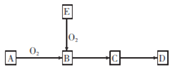
A. 若E、D的水溶液均呈酸性,则A为硫
B. 若D是一种难溶于水的物质,则A为硅
C. 若E、D的水溶液均呈酸性,则B能与水反应
D. 若D是一种难溶于水的物质,则B能与水反应
难度: 困难查看答案及解析