-
周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的电子排布图为_______________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可发生银镜反应。A中存在化学键的类型是______;
A.离子键 B.极性键 C.非极性键 D.σ键 E.π键
B分子官能团中碳原子的轨道杂化类型是____。
(3)用“>”或“<”填空:
第一电离能
熔点
b___d
dc2晶体___d晶体
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子,e元素位于元素周期表的_______区。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体,请书写析出晶体的离子方程式___________________。
(6)e单质为面心立方晶体,其原子半径为rcm,其晶胞棱长为a nm,则e单质的密度为__________g·cm-3,其空间利用率的计算式为_______________________。
高三化学综合题中等难度题查看答案及解析
-
周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的电子排布图为_______________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可发生银镜反应。A中存在化学键的类型是______;
A.离子键 B.极性键 C.非极性键 D.σ键 E.π键
B分子官能团中碳原子的轨道杂化类型是____。
(3)用“>”或“<”填空:
第一电离能
熔点
b___d
dc2晶体___d晶体
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子,e元素位于元素周期表的_______区。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体,请书写析出晶体的离子方程式___________________。
(6)e单质为面心立方晶体,其原子半径为rcm,其晶胞棱长为a nm,则e单质的密度为__________g·cm-3,其空间利用率的计算式为_______________________。
高三化学综合题中等难度题查看答案及解析
-
周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的电子排布图为_______________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可与钠反应放出气体。A中存在的化学键类型是______;
A.离子键 B.共价键 C.金属键 D.氢键
B分子中碳原子的轨道杂化类型是____。
(3)用“>”或“<”填空:
第一电离能
熔点
b___d
dc2晶体___d晶体
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子,e元素位于元素周期表的_______区。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,写出该配离子的化学式______________。
(6)e单质为面心立方晶体,其晶胞棱长为a nm,则e单质的密度为__________g·cm-3,其空间利用率为________。
高三化学综合题中等难度题查看答案及解析
-
A、B、C、D均为短周期元素,他们的原子序数依次增大,B是构成物质种类最多的元素,B和A组成的化合物 B6 A 6 是一种无色透明的液体,不溶于水,密度比水小,C 是地壳中含量最高的非金属元素,D 在同周期元素中原子半径最大。
(1)A、B、D 的元素名称分别为___________、____________、___________
(2)C 在元素周期表中位置为___________________。
(3)A、C、D 能组成多种不同的化合物,这些化合物中既含有极性共价键又含有离子键的化合物为_______________(写电子式,下同),既含有非极性共价键又含有离子键的化合物为_________________。
(4)A 和 D 能组成一种化学活性很高的离子化合物 DA,DA 能和C的单质 C2反应生成一种强碱,请写出 DA 和 C2反应的化学方程式_________________________。
高三化学填空题困难题查看答案及解析
-
短周期元素X、Y、Z、W、M原子序数依次增大,且原子最外层电子数之和为17,X和Y是组成化合物种类最多的元素,W是地壳中含量最高的元素。下列说法正确的是
A. 离子半径大小:M>W>Z
B. 由X、Y、Z、W四种元素形成的化合物一定含离子键
C. Z的简单氢化物比W的简单氢化物更稳定
D. 分子式为Y4X8W2的物质超过6种
高三化学单选题中等难度题查看答案及解析
-
短周期元素X、Y、Z、W、M的原子序数依次增大,且原子最外层电子数之和为18,X与Y是组成化合物种类最多的元素,W是地壳中含量最高的元素。下列说法正确的是
A. 原子半径大小顺序:r(Y)>r(Z )>r(W)>r(M)
B. Z的气态氢化物比W的气态氢化物更稳定
C. 分子式为Y5X12的物质只有3种
D. 由三种元素X、Z、W形成的化合物中只有共价键而无离子键
高三化学选择题中等难度题查看答案及解析
-
六种短周期元素A、B、C、D、E、F的原子序数依次增大,只有E是金属元素,其一种核素的质量数为28,中子数比质子数多2,B是自然界中形成物质种类最多的元素,D是地壳中含量最多的元素;A、C、E、F原子最外层电子数为互不相等的奇数,且A、C、F原子最外层电子数之和恰好等于E元素的核电荷数,A与F最高化合价之和为8,下列说法正确的是
A. A、C、D三种元素形成的化合物一定是共价化合物
B. 工业上常用电解E与F形成的化合物的方法制取单质E
C. 原子半径由大到小的顺序:D>C>B>A
D. B、C、F元素最高价氧化物水化物酸性最强的是F
高三化学选择题困难题查看答案及解析
-
(15分)A、B、C、D、E、F五种短周期元素的原子序数依次增大。周期表中A元素的原子半径最小,B形成化合物种类最多,C是空气中含量最多的元素,D是地壳中含量最多的元素,短周期主族元素中E的原子半径最大且其单质能与冷水剧烈反应,F既能与盐酸反应也能与烧碱溶液反应制得A单质。
(1)B在周期表中的位置是____________________,C的原子结构示意图为________
(2)A、B形成的最简单化合物名称是___________,分子构型是__________________
(3)BD2的结构式为:__________。已知:298K,BD生成1molBD2(g)时放出热量283.0kJ·mol-1,B单质生成1molBD2(g)时放出热量393.5kJ·mol-1,则B单质反应生成BD的热化学方程式为________。
(4)室温时,仅由B、D、E三种元素形成的某种常见的离子化合物水溶液的pH_____7(填“>”、“=”或“<”),理由是(用离子方程式表示)_________________________________
(5)硒(se)是人体必需的微量元素,与D同一主族,Se原子比D原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_________。
(6)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式是
__________________________________________________________
(7)A单质和D单质可组成最简单的燃料电池,若用稀硫酸作电解质,该电池的正极反应式是:______________________________________________
高三化学填空题简单题查看答案及解析
-
X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为____________________。
(2)电负性最大的是_________________,第一电离能介于Y和Z之间的同周期元素有__________ (填元素符号)。
(3)Y和W的氯化物熔点高的是_________(填化学式),原因是____________________________;与Z的低价氯化物互为等电子体的离子是_____________。
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是_____________________,分子中氮原子的杂化类型有_______________。
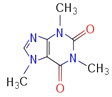
(5)已知WX的密度为3.25g/cm3,单元晶胞边长481pm,试
确定该单元晶胞中含有______个WX,属于__________立方结构(填写面心、简单或体心),晶胞中距离W最近的X有________个。
高三化学综合题困难题查看答案及解析
-
X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X核外未成对电子数有2个,与其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z是遗传物质的组成元素之一;W内层电子数是最外层电子数的9倍;Q基态原子价层电子排布中成对电子数和未成对电子数相同,且成对电子数为最外层电子数的2倍。据此回答下列问题:
(1)Q的基态原子的价层电子排布式为___________________________。
(2)X、Y、Z、W四种元素中,电负性最大的是_________(填元素符号,下同);同周期元素中,第一电高能介于Y 和Z之间的有__________________。
(3)Y 和W的氯化物熔点高的是______(填化学式),原因是_____________________;与Z的低价氯化物互为等电子体的离子是_______(填离子符号)。
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度为2g,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是___________,分子中氮原子的杂化类型有___________________。
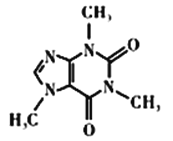
(5)已知WX的密度为3.25 g/cm3,单元晶胞边长481pm,经计算可确定该单元晶胞中含有____个WX,说明在形成晶体时,半径大的粒子先进行了_______方式的堆积,晶胞中距离W最近的X有_____个。
高三化学填空题中等难度题查看答案及解析