-
已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:
O==O
H—H
H—O(g)
1 mol化学键断裂时需要吸收的能量/kJ
496
436
x
则表中x为( )
A. 920 B. 557 C. 463 D. 188
难度: 中等查看答案及解析
-
常温下,某溶液中由水电离产生的c(H+)=1×10-11 mol·L-1,则该溶液的pH可能是( )
A.4 B.7 C.8 D.11
难度: 中等查看答案及解析
-
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中不正确的是( )
A. 该溶液的pH<7
B. HA的酸性很弱,A-的水解程度较大
C. c(A-)+c(HA)=0.02 mol·L-1
D. n(A-)+n(OH-)=0.01 mol+n(H+)
难度: 中等查看答案及解析
-
下列关于盐类水解反应的应用说法正确的是( )
A.可以把FeCl3固体直接溶于水制FeCl3溶液
B.热的纯碱溶液去油污效果好
C.Al(NO3)3溶液与K2S溶液混合后无明显现象
D.Mg粉投入到饱和NH4Cl溶液中无明显现象
难度: 中等查看答案及解析
-
室温下,相同体积的0.5mol·L-1的下列四种溶液:①KCl溶液、②FeCl3溶液、③HF溶液、④Na2CO3溶液,其中所含阳离子数由多到少的顺序是( )
A. ④>①=②>③ B. ①>④>②>③ C. ④>①>③>② D. ④>②>①>③
难度: 中等查看答案及解析
-
用标准KOH溶液滴定未知浓度的盐酸,若测定结果偏低,则原因可能是( )
A. 配制标准溶液的固体KOH中混有NaOH杂质
B. 滴定到终点时,仰视读数,其他操作正确
C. 盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D. 滴定到终点读数时,发现滴定管尖嘴处悬挂了一滴溶液
难度: 中等查看答案及解析
-
在一支25 mL的酸式滴定管中盛入0.1 mol·L-1HCl溶液,其液面恰好在5 mL的刻度处,若滴定管中的溶液全部放入烧杯中,然后用0.1 mol·L-1NaOH溶液进行中和,则需NaOH溶液的体积( )
A. 大于20 mL B. 小于20 mL
C. 等于20 mL D. 等于5 mL
难度: 中等查看答案及解析
-
常温下,将pH=3的H2SO4溶液与pH=9的NaOH溶液混合,若要得到pH=7的溶液,则混合时H2SO4溶液与NaOH溶液的体积比为( )
A. 1:200 B. 200:1 C. 100:1 D. 1:100
难度: 中等查看答案及解析
-
S16O2与18O2在高温条件下发生反应2SO2+O2
2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
A. 只有SO3 B. 只有SO2、SO3 C. 有SO2、SO3、O2 D. 只有O2、SO3
难度: 简单查看答案及解析
-
对于反应2SO2+O2
2SO3,下列判断正确的( )
A. 标准状况下,2L SO2和足量O2反应最终生成2L SO3
B. 平衡时,再向容器中通入O2,可使SO2的转化率达到100%
C. 平衡时,SO2的消耗速率必定等于O2生成速率的二倍
D. 平衡时,SO2的浓度必定等于O2浓度的二倍
难度: 简单查看答案及解析
-
下列不能用焓判据解释的自发进行的过程是( )
A. 铁在潮湿空气中生锈了 B. 天然气的燃烧
C. 铜在潮湿空气中产生铜绿 D. NH4Cl与Ba(OH)2·8H2O反应产生NH3
难度: 简单查看答案及解析
-
可逆反应A+3B
2C+2D在4种不同条件下的反应速率(单位为mol·L-1·s-1)分别为①v(A)=0.15 ②v(B)=0.6 ③v(C)=0.4 ④v(D)=0.45该反应反应速率最快的条件是( )
A. ② B. ④ C. ①和④ D. ②和③
难度: 中等查看答案及解析
-
如图所示装置,电流表G发生偏转,同时X极逐渐变粗,Y极逐渐变细,Z是电解质溶液,则X,Y,Z应是下列各组中的

A. X是Zn,Y是Cu,Z为稀H2SO4
B. X是Cu,Y是Zn,Z为稀H2SO4
C. X是Fe,Y是Ag,Z为稀AgNO3溶液
D. X是Ag,Y是Fe,Z为稀AgNO3溶液
难度: 简单查看答案及解析
-
根据下图所给信息,得出的结论正确的是
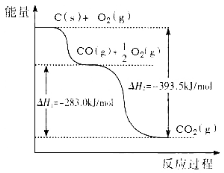
A.48g碳完全燃烧放出热量为1574 kJ/mol
B.2C(s)+O2(g)
2CO(g) △H=-221.0kJ/mol
C.2CO2(g)
2CO(g)+O2(g) △H=+283.0kJ/mol
D.C(s)+O2(g)
CO2(s) △H=-393.5kJ/mol
难度: 简单查看答案及解析
-
在硫化氢的水溶液中,存在以下平衡:H2S
HS-+H+、HS-
H++S2-,若使溶液的pH减小,则c(S2-)
A. 增大 B. 减小
C. 不变 D. 可能增大也可能减小
难度: 中等查看答案及解析
-
向某4L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示。乙图为达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,且所改变的条件均不同。已知t3-t4阶段为使用催化剂。则下列说法不正确的是
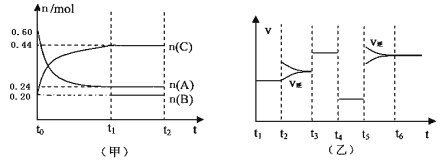
A.若t1=15s,则t0—t1阶段以A浓度变化表示的反应速率v(A)为0.006mol/(L·s)
B.B既不是反应物,也不是生成物,可能是反应的催化剂
C.若t2—t3阶段改变的条件是增大A的浓度,则平衡时C的体积分数变小。
D.该反应为放热反应,t5—t6阶段是升高反应体系的温度
难度: 困难查看答案及解析