-
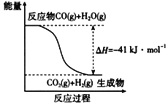
下列说法正确的是
A. 反应物的热效应与是否使用催化剂无关
B. 4NO2(g)+O2(g)=2N2O5 (g)的过程属于熵增加过程
C. 由C(石墨)= C(金刚石)△H﹥0,可知金刚石比石墨稳定
D. 对任何化学反应来说,反应速率越大,反应现象就越明显
难度: 简单查看答案及解析
-
能促进水的电离,并使溶液中c(H+)>c(OH)的操作是
(1) 将水加热煮沸 (2) 向水中投入一小块金属钠 (3) 向水中通HCl (4) 向水中加入明矾晶体 (5)向水中加入NaHCO3固体 (6)向水中加KHSO4固体
A. (4) B. (1)(4)(6) C. (1)(3)(6) D. (4)(6)
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. pH=1的溶液中:Na+、K+、MnO4-、CO32-
B. c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3-
C. 0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl-
D. 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
难度: 中等查看答案及解析
-
高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析。以下观点中不正确的是
①放热反应在常温下均能自发进行;
②电解过程中,电能转化为化学能而“储存”在反应物中;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,化学反应只向吸热反应方向进行;
⑤化学平衡常数的表达式与化学反应方程式的书写无关。
A. ①②③④ B. ①③④⑤ C. ②③⑤ D. ①②④⑤
难度: 中等查看答案及解析
-
反应M+Z→Q(△H<0)分两步进行:①M+Z→X(△H>0),②X→Q(△H<0).下列示意图中,能正确表示总反应过程中能量变化的是( )
A.
 B.
B. 
C.
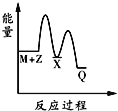 D.
D. 
难度: 中等查看答案及解析
-
下列有关热化学方程式书写及对应表述均正确的是( )
A. 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ.mol-1
B. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
C. 已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ.mol-1
D. 已知2C(s)+O2(g)═2CO(g)△H=-22.1kJ.mol-1则可知C的燃烧热△H=-110.5kJ.mol-1
难度: 中等查看答案及解析
-
下列关于电解质分类的组合中,完全正确的是( )
A
B
C
D
强电解质
NaCl
H2SO4
HClO
HNO3
弱电解质
HF
BaSO4
CaCO3
CH3COOH
非电解质
Cl2
CS2
C2H5OH
SO2
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列事实中,不能用勒夏特列原理揭示的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压回颜色变深
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业上生产硫酸的过程中使用过量的空气以提高SO2的利用率
难度: 简单查看答案及解析
-
在密闭容器中,反应2NO2(g)
N2O4(g),在不同条件下的化学平衡情况如图a、图b所示。图a表示恒温条件下c(NO2)的变化情况,图b表示恒压条件下,平衡体系中N2O4的质量分数随温度变化情况(实线上的任意一点为平衡状态)。下列说法正确的是( )
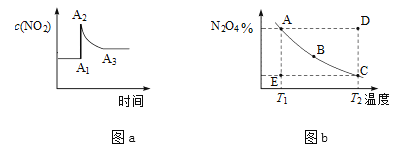
A. 图a 中,A1→A2变化的原因一定是充入了NO2
B. 图b中,E点对应状态中,v(正)> v(逆)
C. 图b中,E→A所需的时间为x,D→C所需时间为y,则x < y
D. 依据图b分析可知,该化学反应△H>0
难度: 中等查看答案及解析
-
下列图示与对应的叙述符合的是
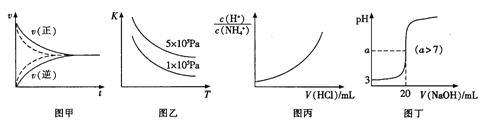
A. 用甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B. 图乙表示反应2SO2(g)+O2(g)
2SO3(g)△H<0的平衡常数K与温度和压强的关系
C. 图丙表示向0.1mol/L的NH4Cl溶液中滴加0.1mol/L的HCl溶液时,溶液中
随HCl溶液体积变化关系
D. 图丁表示常温下向20mL pH=3的醋酸中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
难度: 困难查看答案及解析
-
一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. 常温下,0.1mol/LpH=7.82的NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+)
D. pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③
难度: 困难查看答案及解析
-
下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO
)+c(HCO
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
A. ①④ B. ②⑤ C. ①③ D. ②④
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A. 将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干均得不到原溶质
B. 保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解
C. 室温下,向0.1mol/L的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大
D. NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
难度: 中等查看答案及解析
-
下面有关电化学的图示,完全正确的是
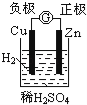
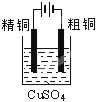
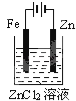
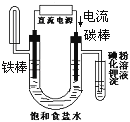
A. Cu﹣Zn原电池
B. 粗铜的精炼
C. 铁片镀锌
D. 验证NaCl溶液(含酚酞)电解产物
难度: 中等查看答案及解析
-
用石墨作电极电解3 mol·L-1KCl和0.5 mol·L-1Al2(SO4)3的1 L混合溶液时,下图电解变化曲线合理的是( )
A.
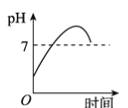 B.
B.  C.
C. 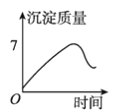 D.
D. 
难度: 中等查看答案及解析
-
下列叙述中,正确的是
①锌跟稀硫酸反应制取氢气,加入少量CuSO4溶液能提高反应速率 ②镀层破损后,白铁(镀锌的铁)比马口铁(铁锡的铁)更易腐蚀; ③电镀时应把镀件置于电解槽的阴极 ;④冶炼铝时,把氧化铝加热成为熔融体后电解 ⑤钢铁表面常易腐蚀生成Fe2O3·nH2O
A.①②③④⑤ B.①③④⑤ C.①③⑤ D.②④
难度: 中等查看答案及解析