-
已知t ℃时,0.01 mol/L NaOH溶液的pH=11,0.1 mol/L的HA溶液中c(H+)/c(OH-)=109
请回答下列问题:
(1)该温度下,水的离子积Kw=_____,0.1 mol/L的HA溶液中水电离出的c(OH-)=_____。
(2)在室温下,将pH之和为14的NaOH溶液和HA溶液等体积混合后,所得溶液呈_____(填“酸”“碱”或“中”)性。
(3)在室温下,蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是_____。
A.水的电离程度 B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值
(4)室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:
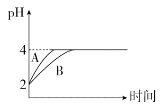
①图中表示HA溶液pH变化曲线的是____(填“A”或“B”)。
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1_____m2(填“>”“<”或“=”)。
(5)室温下,取0.01 mol/L的盐酸和HA溶液各100 mL,分别滴加0.01 mol/LNaOH溶液至恰好完全反应,所需NaOH溶液的体积前者____后者(填“>”“<”或“=”)。
-
已知t ℃时,0.01 mol/L NaOH溶液的pH=11,0.1 mol/L的HA溶液中c(H+)/c(OH-)=109
请回答下列问题:
(1)该温度下,水的离子积Kw=_____,0.1 mol/L的HA溶液中水电离出的c(OH-)=_____。
(2)在室温下,将pH之和为14的NaOH溶液和HA溶液等体积混合后,所得溶液呈_____(填“酸”“碱”或“中”)性。
(3)在室温下,蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是_____。
A.水的电离程度 B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值
(4)室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:
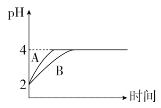
①图中表示HA溶液pH变化曲线的是____(填“A”或“B”)。
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1_____m2(填“>”“<”或“=”)。
(5)室温下,取0.01 mol/L的盐酸和HA溶液各100 mL,分别滴加0.01 mol/LNaOH溶液至恰好完全反应,所需NaOH溶液的体积前者____后者(填“>”“<”或“=”)。
-
某小组在某温度下测定溶液的pH时发现,0.01mol/L的NaOH溶液中,c(H+)·c(OH-)=10-12(mol/L)2,则该小组在该温度下测得0.1mol/LNaOH溶液和0.1mol/LHCl溶液pH应为
A.13、1 B.13、2 C.11、1 D.10、2
-
下列有关0.1 mol·L-1 NaOH 溶液的叙述正确的是( )。
A.1L该溶液中含有NaOH 40g
B.100 mL该溶液中含有OH- 0.01mol
C.从1L该溶液中取出100mL,所取出的NaOH溶液的浓度为0.01 mol·L-1
D.在1 L水中溶解4g NaOH即可配制得0.1 mol·L-1 NaOH溶液
-
某探究小组在某温度下测定溶液的pH值时发现,0.01mol•L-1的NaOH溶液中,由水电离出的c(H+)•c(OH-)=10-222,则该小组在该温度下测得0.1mol•L-1的NaOH溶液pH值应为( )
A.13
B.12
C.11
D.10
-
某探究小组在某温度下测定溶液的pH值时发现,0.01mol/L的NaOH溶液中,由水电离出的c(H+)×c(OH+)=10-22,则该小组在该温度下测得0.1mol/L的NaOH溶液的pH值应为( )
A.13 B.12 C.11 D.10
-
某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的NaOH溶液中,由水电离出的
c(H+)·c(OH-)=10-22,则该小组在该温度下测得0.1mol·L-1NaOH溶液的pH应为
A.13 B.12 C.11 D.10
-
某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22,则该小组在该温度下测得0.1mol·L-1NaOH溶液的pH应为
A.13 B.12 C.11 D.10
-
常温下,下列四种溶液:①c(H+)=10-3mol·L-1的醋酸 ②0.01mol·L-1的盐酸 ③0.1mol·L-1的NaOH溶液 ④c(OH-)=1mol·L-1氨水溶液。由水电离出的氢离子浓度之比为
A. 1000∶100∶10∶1 B. 11∶12∶1∶0
C. 11∶12∶13∶14 D. 3∶2∶13∶14
-
25℃下列四种溶液:①c(H+)=1mol·L-1的醋酸②0.1mol·L-1的盐酸③0.01mol·L-1的NaOH溶液 ④c(OH-)=10-3mol·L-1氨水溶液。由水电离出的氢离子浓度之比为
A. 1∶10∶100∶1000 B. 0∶1∶12∶11
C. 14∶13∶12∶11 D. 14∶13∶2∶3

