-
下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(−57.3)kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=2×(+283.0 kJ·mol-1)
C. 需要加热才能发生的反应一定是吸热反应
D. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是
A. 未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B. 加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-)
C. 加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D. 加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 化学反应除了生成新物质外,还伴随着能量的变化
B. 放热反应都不需要加热就能发生
C. 吸热反应在一定条件(如高温、加热等)下也能发生
D. 化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量
难度: 简单查看答案及解析
-
下列有关溶液组成的描述合理的是
A. 无色溶液中可能大量存在Al3+、NH4+、Cl‾、S2‾
B. 酸性溶液中可能大量存在Na+、ClO‾、SO42‾、I‾
C. 弱碱性溶液中可能大量存在Na+、K+、Cl‾、HCO3‾
D. 中性溶液中可能大量存在Fe3+、K+、Cl‾、SO42‾
难度: 中等查看答案及解析
-
对于:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l);△H =-5800kJ/mol的叙述错误的是
A. 该反应的反应热为△H=-5800kJ/mol,是放热反应
B. 该反应的△H与各物质的状态有关,与化学计量数也有关
C. 该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ
D. 该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol
难度: 简单查看答案及解析
-
一定条件下的密闭容器中: 4NH3(g)+5O2(g)⇌ 4NO(g)+6H2O(g),△H=-905.9kJ·mol-1, 下列叙述正确的是
A. 4mol NH3和5mol O2反应, 达到平衡时放出热量为905.9kJ
B. 平衡时v正(O2)=v逆(NO)
C. 平衡后降低压强, 混合气体平均摩尔质量增大
D. 平衡后升高温度, 混合气体中NO含量降低
难度: 中等查看答案及解析
-
下列关于反应能量的说法正确的是( )
A. Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,则反应物总能量>生成物总能量
B. 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2
C. 101 kPa时,2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1,则H2的燃烧热为571.6 kJ·mol-1
D. H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量
难度: 简单查看答案及解析
-
在36 g碳不完全燃烧所得气体中,CO占
体积,CO2占
体积。且有:
C(s)+
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
CO(g)+
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJ B. 1 149 kJ C. 283 kJ D. 517.5 kJ
难度: 中等查看答案及解析
-
对于平衡体系mA(g)+nB(g)
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若温度不变时压强增大到原来的2倍,达到新平衡时,总体积一定比原来的
要小
难度: 困难查看答案及解析
-
在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之反应:2SO2(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是( )
A. 第一次平衡时反应放出的热量为294.9 kJ
B. 两次平衡SO2的转化率相等
C. 第二次达平衡时SO3的体积分数大于
D. 达平衡时用O2表示的反应速率为0.25 mol·(L·min)-1
难度: 中等查看答案及解析
-
在一定条件下,固定容积的密闭容器中反应:2NO2(g)
O2(g)+2NO(g) ΔH>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是
A. 当X表示温度时,Y表示O2的物质的量
B. 当X表示压强时,Y表示NO2的转化率
C. 当X表示反应时间时,Y表示混合气体的密度
D. 当X表示NO2的物质的量时,Y表示O2的物质的量
难度: 中等查看答案及解析
-
在一定条件下,对于反应mA(g)+nB(g)
cC(g)+dD(g),C物质的质量分数w(C)与温度、压强的关系如图所示,下列判断正确的是( )
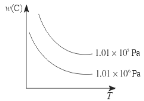
A.ΔH<0,m+n<c+d
B.ΔH>0,m+n>c+d
C.ΔH>0,m+n<c+d
D.ΔH<0,m+n>c+d
难度: 简单查看答案及解析
-
下列各组物质全部是弱电解质的是
A.H2O、NH3·H2O、H3PO4、HF B.Cu(OH)2、CH3COOH、C2H5OH、CH3COONa
C.H2SO3、Ba(OH)2、BaSO4 D.SO2、H2S、CO2
难度: 简单查看答案及解析
-
同温度下的四种溶液,当NH4+浓度相同时,溶液的物质的量浓度最大的是
A. NH4Al(SO4)2 B. NH4Cl C. NH3·H2O D. CH3COONH4
难度: 简单查看答案及解析
-
下列关于电解质溶液的叙述正确的是( )
A. 室温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c(Cl-)>c(NH
)>c(H+)=c(OH-)
B. 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D. 室温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
难度: 困难查看答案及解析
-
常温下,浓度均为1.0 mol·L-1的NH3·H2O和NH4Cl混合溶液10 mL,测得其pH为9.3。下列有关叙述正确的是( )
A. 加入适量的NaCl,可使c(NH4+)=c(Cl-)
B. 滴加几滴浓氨水,c(NH4+)减小
C. 滴加几滴浓盐酸,
的值减小
D. 1.0 mol·L-1的NH4Cl溶液中c(NH4+)比该混合溶液中的大
难度: 困难查看答案及解析
-
实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列对测定结果评价错误的是
选项
操作
测定结果评价
A
酸式滴定管在装液前未用标准盐酸润洗2~3次
偏高
B
开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
偏高
C
锥形瓶未干燥
无影响
D
盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
偏低
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.8×10-13。现将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为
A. 只有AgBr沉淀
B. AgCl和AgBr沉淀等量生成
C. AgCl和AgBr沉淀都有,但以AgCl沉淀为主
D. AgCl和AgBr沉淀都有,但以AgBr沉淀为主
难度: 简单查看答案及解析
-
在K2CrO4溶液中存在着如下平衡2CrO42-+ 2H+
Cr2O72-+ H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1LK2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
A. >7 B. <7 C. =7 D. 无法确定
难度: 简单查看答案及解析
-
20mL0.1mol/LFeCl3溶液中含有部分Fe2+,向其中滴加NaOH溶液至PH=4,溶液中有沉淀生成,过滤,得沉淀和滤液。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16。
下列说法错误的是
A. 沉淀中只有Fe(OH)3 B. 沉淀中有Fe(OH)3和Fe(OH)2
C. 滤液c(Fe3+)=4.0×10-8mol/L D. 向滤液中滴加FeCl2溶液,无沉淀产生
难度: 中等查看答案及解析