-
2018年“地球一小时“活动号召公众开启绿色行为方式。下列做法不符合绿色行为方式的是
A. 优先选择私家车出行 B. 理性购物,适度点餐不浪费
C. 购物自带环保袋,少用塑料包装 D. 垃圾尽量分类,电子设备以旧换新
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
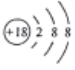
A. 原子核内有10个中子的氧原子:
B. 硫离子的结构示意图:
C. 次氯酸钠的电子式:
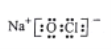 D. 葡萄糖分子的结构简式:C6H12O6
D. 葡萄糖分子的结构简式:C6H12O6难度: 简单查看答案及解析
-
下列物质性质与应用对应关系正确的是
A. 氨气易溶于水,可用作制冷剂
B. 浓硫酸具有脱水性,可用于气体的干燥
C. 二氧化硫具有氧化性,可用于纸浆的漂白
D. 碳化硅硬度大,可用作砂纸、砂轮的磨料
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W质子序数依次增大,其中X的一种单质是自然界硬度最大的物质,Y原子的最外层电子数是内层电子数的3倍,Z是短周期元素中金属性最强的元素,W与X同主族。下列说法正确的是
A. 原子半径:r(X)<r(Y)<r(Z)<r(W)
B. X的氢化物的热稳定性比Y的强
C. W的最高价氧化物的水化物是一种强酸
D. Y与Z形成的化合物中可能存在共价健
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 将饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
B. 向硫酸铝溶液中滴加过量氨水:2Al3++6NH3·H2O=2Al(OH)3↓+6NH4+
C. 向NaClO溶液中通入过量的SO2:SO2+ClO-+H2O=HSO3-+HClO
D. 向(NH4)2Fe(SO4)2溶液中滴加过量NaOH溶液:Fe2++2OH-=Fe(OH)2↓
难度: 中等查看答案及解析
-
下列装置正确的是
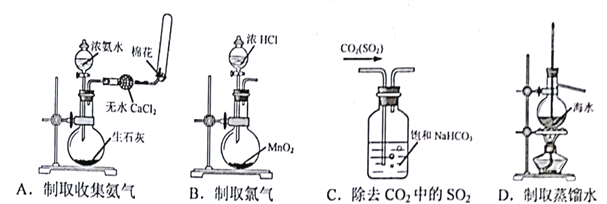
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
在给定条件下,下列选项中所示的物质间转化均能实现的是
A. SiO2
H2SiO3
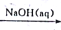 Na2SiO3
Na2SiO3B. S
SO2
BaSO3
C. CuSO4(aq)
 Cu(OH)2
Cu(OH)2Cu2O
D. 饱和NaCl溶液
NaHCO3
Na2CO3
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶被中一定能大量共存的是
A. 澄清透明的溶液中:Fe3+,Ba2+、NO3-、Cl-
B. 使酚酞变红色的溶液中:Na+、NH4+、C1-、SO42-
C. c(Al3+)=0.1mol/L的溶液中:K+、Mg2+、SO42-、AlO2-
D. 由水电商产生的c(H+)=10-13mol/L的溶被中:K+、Na+、CH3COO-、NO3-
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
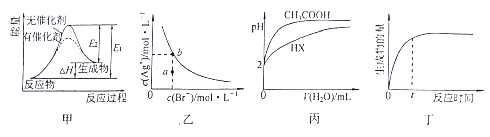
A. 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化
B. 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液
C. 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH
D. 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
难度: 中等查看答案及解析
-
CO、H2、C2H5OH三种物质燃烧的热化学力程式如下:
①CO(g)+1/2O2(g)=CO2(g) ΔH1=a kJ/mol
②H2(g)+1/2O2(g)=H2O(g) ΔH2=bkJ/mol
③C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=ckJ/mol
下列说法确的是
A. ΔH1>0
B. 2H2O(1)=2H2(g)+O2(g) ΔH=-2bkJ/mol
C. CO2与H2合成C2H5OH反应的原子利用率为100%
D. 2CO(g)+4H2(g)=H2O(g)+C2H5OH(1) ΔH=(2a+4b-c)kJ/mol
难度: 中等查看答案及解析
-
下列说法正确的是
A. CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<O
B. 若在海轮外壳上附着一些锌块,则可以减缓海轮外壳的腐蚀
C. 1molNa2O2与足量H2O反应产生O2,理论上转移的电子数约为2×6.02×1023
D. 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
难度: 中等查看答案及解析
-
由下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向FeCl3溶液中滴加SnCl2溶液,黄色褪去
还原性:Fe2+>Sn2+
B
向溴水中通入某无色气体,溴水褪色
该气体一定是SO2
C
向溶液X中滴加新制氯水,再滴加KSCN溶液,溶液出现红色
溶液X中含Fe2+
D
向2.0mL浓度均为0.1mol/LKCl和KI混合溶液中滴加2滴0.1mol/L的AgNO3溶液,振荡,沉淀呈黄色
Ksp(AgCl)>Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
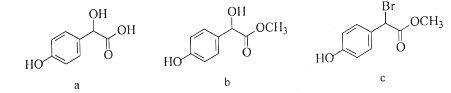
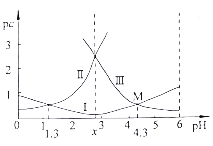
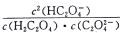 随pH的升高而增大
随pH的升高而增大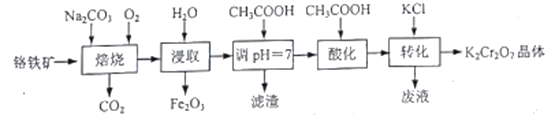
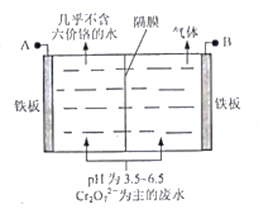
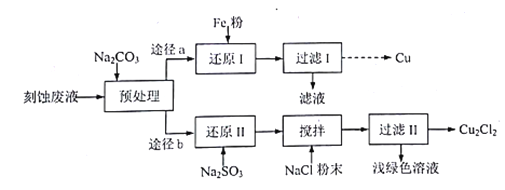
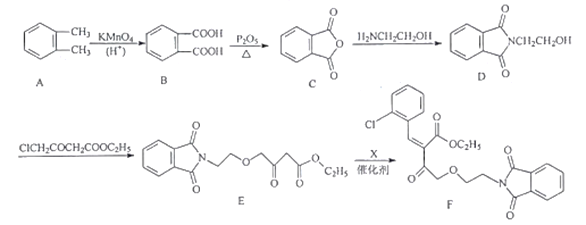
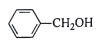 为原料制备
为原料制备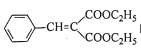 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________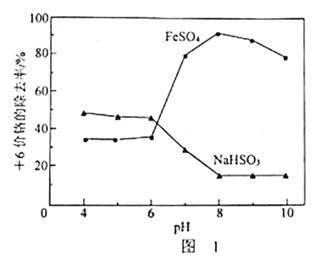
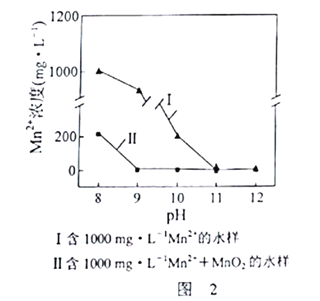
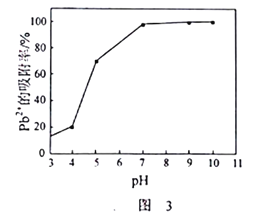
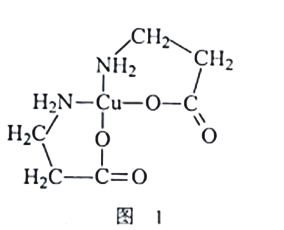
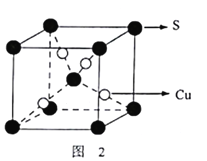 。
。