-
下列既有离子键又有共价键的化合物是( )
A. Na2O B. NaOH C. CaBr2 D. HF
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 1s22s12p1表示的是激发态原子的核外电子排布
B. 3p2表示3p能级有两个轨道
C. 同一原子中,1s、2s、3s电子的能量逐渐减小
D. 同一原子中,2p、3p、4p能级中的轨道数依次增多
难度: 中等查看答案及解析
-
下列物质的变化过程中有共价键明显被破坏的是( )
①I2升华 ②氯化钠溶于水 ③氯化氢溶于水 ④碳酸氢铵中闻到了刺激性气味
A. ①② B. ①③ C. ②③ D. ③④
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 离子晶体的晶格能越大离子键越强
B. 阳离子的半径越大则可同时吸引的阴离子越多
C. 通常阴、阳离子的半径越小、电荷越大,该阴阳离子组成离子化合物的晶格能越大
D. 拆开1mol离子键所需的能量叫该离子晶体的晶格能
难度: 中等查看答案及解析
-
某元素基态原子失去3个电子后,3d轨道半充满,其原子序数为( )
A. 24 B. 25 C. 26 D. 27
难度: 中等查看答案及解析
-
下列各组原子中,彼此化学性质一定相似的是( )
A. 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B. 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C. 2p轨道上只有两个电子的X原子与3p轨道上只有两个电子的Y原子
D. 最外层都只有一个电子的X、Y原子
难度: 中等查看答案及解析
-
下列事实不能用键能的大小来解释的是( )
A. N元素的电负性较大,但N2的化学性质很稳定
B. 惰性气体一般难发生反应
C. HF、HCl、HBr、HI的稳定性逐渐减弱
D. F2比O2更容易与H2反应
难度: 中等查看答案及解析
-
从键长的角度来判断下列共价键中最稳定的是( )
A. H—F B. H—N C. H—C D. H—S
难度: 中等查看答案及解析
-
构成金属晶体的微粒是
A. 原子 B. 分子 C. 金属阳离子 D. 金属阳离子和自由电子
难度: 简单查看答案及解析
-
已知SO3,BF3,CCl4,PCl5、SF6都是非极性分子,而H2S,NH3,NO2、SF4,BrF5都是极性分子,由此可推出ABn型分子属于非极性分子的经验规律是( )
A. ABn型分子中A,B均不含氢原子
B. A元素的相对原子质量必小于B元素的相对原子质量
C. 分子中所有原子都在同一平面上
D. ABn型的价电子对数等于n
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. π键是由两个p电子以“头碰头”方式重叠而成
B. σ键是镜面对称,而π键是轴对称
C. 乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D. H2分子中含σ键,Cl2分子中含π键
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A. σ键比π键重叠程度大,形成的共价键强
B. 两个原子之间形成共价键时,最多有一个σ键
C. 气体单质中,一定有σ键,可能有π键
D. N2分子中有一个σ键,两个π键
难度: 中等查看答案及解析
-
钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是( )
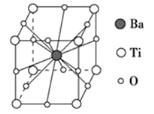
A. BaTi8O12 B. BaTi4O6 C. BaTi2O4 D. BaTiO3
难度: 中等查看答案及解析
-
当一个碳原子所连四个不同原子或原子团时,该碳原子叫“手性碳原子”。下列化合物中含有2个手性碳原子的是( )
A.
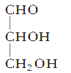 B.
B.  C.
C. 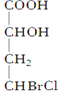 D.
D. 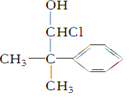
难度: 简单查看答案及解析
-
下列有关离子晶体的数据大小比较不正确的是( )
A. 熔点:NaF>MgF2>AlF3
B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaCl>CaF2
D. 硬度:MgO>CaO>BaO
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 基态氧原子与基态氮原子中未成对电子数之比是2∶3
B. 基态氮原子与基态磷原子中未成对电子数之比是1∶1
C. 基态碳原子与基态氮原子中未成对电子数之比是3∶4
D. 基态铜原子中未成对电子数是1
难度: 简单查看答案及解析
-
下列说法正确的是
A. NaOH是含有非极性共价键的离子晶体
B. 氯化钠与氯化铯的晶体结构完全相同
C. 金刚石、硅、锗的熔点和硬度依次降低
D. NaF、MgF2、AlF3三种离子晶体的晶格能逐渐减小
难度: 简单查看答案及解析
-
下列不属于金属晶体的共性的是( )
A. 易导电 B. 易导热 C. 有延展性 D. 高熔点
难度: 简单查看答案及解析
-
下列表示式错误的是( )
A. Na+的轨道表示式:

B. Na+的结构示意图:
C. Na的电子排布式:1s22s22p63s1
D. Na的外围电子排布式:3s1
难度: 中等查看答案及解析
-
下列现象不能用“相似相溶原理”解释的是( )
A. 氯化氢易溶于水 B. 氯气易溶于氢氧化钠溶液中
C. 碘易溶于四氯化碳 D. 碘难溶于水
难度: 简单查看答案及解析
-
以下叙述中,错误的是( )
A. 钠原子和氯原子作用生成NaCl后,其结构的稳定性增强
B. 在氯化钠中,除氯离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
C. 任何离子键在形成的过程中必定有电子的得与失
D. 金属钠与氯气反应生成氯化钠后,体系能量降低
难度: 中等查看答案及解析
-
下列变化中,不存在化学键断裂的是
A. 氯化氢气体溶于水 B. 干冰气化
C. 氯化钠固体溶于水 D. 氢气在氯气中燃烧
难度: 中等查看答案及解析
-
在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔沸点越高。由此判断下列各组金属熔沸点高低顺序,其中正确的是( )
A. Mg>Al>Ca B. Al>Na>Li
C. Al>Mg>Ca D. Mg>Ba>Al
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 处于最低能量的原子叫做基态原子
B. 原子由基态变为激发态要产生发射光谱
C. 同一原子中,2p能级比3p能级的轨道数少
D. 3d轨道能量小于4s
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. 同一周期中,第ⅦA族元素的原子半径最大
B. 第ⅥA族元素的原子,其半径越大,越容易得到电子
C. 室温时,0族元素的单质都是气体
D. 同一周期中,碱金属元素的第一电离能最大
难度: 中等查看答案及解析
-
下列电子排布式或电子排布图正确的是( )
A. O的电子排布图:

B. Ca的电子排布式:1s22s22p63s23p63d2
C. N的电子排布图:

D. Br-的电子排布式:[Ar]3d104s24p6
难度: 简单查看答案及解析
-
通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是
A. CH4和
是等电子体,键角均为60°
B.
和
是等电子体,均为平面正三角形结构
C. H3O+和PCl3是等电子体,均为三角锥形结构
D. B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
难度: 中等查看答案及解析
-
下列有关范德华力的叙述正确的是( )
A. 范德华力的实质也是一种电性作用,所以范德华力是一种特殊的化学键
B. 范德华力与化学键的区别是作用力的强弱不同
C. 任何分子间在任意情况下都会产生范德华力
D. 范德华力非常微弱,故破坏范德华力不需要消耗能量
难度: 简单查看答案及解析
-
最近发现了一种由金属原子M和非金属原子N构成的气态团簇分子,如图所示,顶角和面的原子是M原子,棱中心和体心的原子是N原子,它的分子式为( )
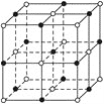
A. M4N4 B. MN C. M14N13 D. 条件不够,无法写出
难度: 中等查看答案及解析