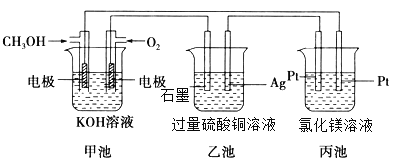
-
下列表述中,关于“一定”说法正确的个数是
①pH=6的溶液一定是酸性溶液
②c(H+)>c(OH-)一定是酸性溶液
③强电解质溶液的导电能力一定大于弱电解质溶液的导电能力
④25℃时,水溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
⑤使用pH试纸测定溶液阳时若先润湿,则测得溶液的pH一定有影响
⑥0.2mol/L氢硫酸溶液加水稀释,电离程度增大,c(H+)一定增大
⑦温度保持不变,向水中加入钠盐对水的电离一定没有影响
A. 0 B. 1 C. 2 D. 3
难度: 中等查看答案及解析
-
在pH相同,体积相等的盐酸A和醋酸溶液B中,分别加入等质量的锌,若反应停止后,有一份溶液中锌有剩余,则正确的判断是
①生成等量H2时反应所需时间B>A ②开始时反应速度A>B
③参加反应的锌的质量B>A ④整个反应阶段平均速度B>A
⑤盐酸中锌有剩余 ⑥醋酸溶液中锌有剩余
⑦盐酸中放氢气多 ⑧醋酸溶液中放氢气多
A. ③④⑤⑧ B. ①③⑥⑦ C. ①②③⑥ D. ②③④⑤
难度: 困难查看答案及解析
-
化学与生产和生活密切相关,下列过程中没有发生化学变化的是( )
A. 用热碱水清除炊具上的油污 B. 电解饱和食盐水制氯气
C. 用酒精擦洗布料上的油污 D. 用食醋除去水壶内的水垢
难度: 简单查看答案及解析
-
室温下,下列溶液中粒子浓度关系正确的是( )
A. Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B. Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C. Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D. CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
难度: 困难查看答案及解析
-
下列事实不能用平衡移动原理解释的是
A. 夏天打开啤酒瓶盖后产生大量气泡
B. 浓氨水中加入NaOH 固体产生有刺激性气味气体
C. 实验室用排饱和食盐水的方法收集氯气
D. 压缩H2和I2反应的平衡混合气体,气体颜色变深
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液中,按pH由小到大顺序排列的是( )
A. Na2CO3NaHCO3NaCl HCl
B. Na2CO3NaHCO3HCl NaCl
C. (NH4)2SO4NH4Cl NaNO3Na2CO3
D. NH4Cl (NH4)2SO4Na2CO3NaNO3
难度: 中等查看答案及解析
-
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
A. 电解时以精铜作阳极
B. 电解时阴极发生氧化反应
C. 粗铜连接电源负极,其电极反应是Cu-2e-===Cu2+
D. 电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
难度: 中等查看答案及解析
-
化学平衡常数(K)电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大
B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C.向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3)
D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
难度: 中等查看答案及解析
-
已知AgCl 的Ksp=1.8×10-10,在100mL1.0×10 -4mol/L 的KCl 溶液中,加入100mL2.0×10-6mol/L的AgNO3 溶液,下列说法正确的是
A. 有AgCl 沉淀生成 B. 无AgCl沉淀生成
C. 有沉淀生成但不是AgCl D. 无法确定
难度: 中等查看答案及解析
-
用直流电电解下列各溶液一段时间后,溶液的颜色和密度保持不变的是
A. 用铜电极电解稀H2SO4 B. 用石墨电极电解Na2SO4溶液
C. 用铜电极电解CuCl2溶液 D. 铁为阳极,锌为阴极,电解ZnCl2溶液
难度: 简单查看答案及解析
-
常温时,将V1mL c1mol·L-1的氨水滴加到V2mL c2moL·L-1的盐酸中,下列结论中正确的是
A. 若混合溶液的pH=7,则c1V1>c2V2
B. 若V1=V2,c1=c2,则溶液中c (NH4+) =c (Cl-)
C. 若混合溶液的pH=7,则溶液中c (NH4+)>c (Cl-)
D. 若V1=V2,且混合液的pH<7,则可能有c1 = c2
难度: 中等查看答案及解析
-
假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是
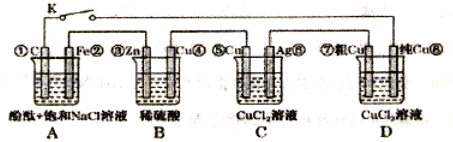
A. 当K断开时,B装置锌片溶解,有氢气产生
B. 当K闭合后,C装置可作为电镀池装置
C. 当K闭合时,A装置发生吸氧腐蚀,在电路中做电源
D. 当K闭合后,A、B装置中pH变大,C、D装置中pH不变
难度: 中等查看答案及解析
-
常温下将浓度均为0.1 mol / L的CH3COOH和CH3COONa两溶液等体积混合,混合溶液的pH<7,有关叙述正确的是( )
A.c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.向混合后的溶液中滴入NaOH溶液至pH=7,则有c(Na+)=c(CH3COO—)
D.混合溶液加水稀释,c(OH— )减小
难度: 中等查看答案及解析
-
室温时,下列比值为2∶1的是
A. pH=2 与pH=1的硝酸中c(H+)之比
B. Na2CO3溶液中c(Na+)与c(CO32-)之比
C. 0.2mol/L 与0 lmol/L 醋酸中c(H+)之比
D. pH=7的硫酸铵与氨水混合溶液中c(NH4+)与c(SO42-)之比
难度: 中等查看答案及解析
-
常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是
A. 物质的量浓度c (甲)>10c(乙)
B. 甲中水电离出来的H+的物质的量浓度是乙中水电离出来的H+的物质的量浓度的10倍
C. 中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,V(甲)=10V(乙)
D. 甲中的c (OH-)为乙中的c (OH-)的10倍
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A. 若C(石墨,s)=C(金刚石,s) AH>0,则石墨比金刚石稳定
B. 2H2(g)+O2(g)==2H2O(g) ΔH=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ•mol-1
C. 已知NaOH(aq)+ HCl(aq)=NaCl(aq) +H2O(1) ΔH=-57.3kJ·mol-1,则20.0 gNaOH固体与稀盐酸完全中和,放出28.65kJ的热量
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1 2C(S)+O2(g)--2CO(g) ΔH2 则ΔH1>ΔH2
难度: 中等查看答案及解析
-
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。工业上以铬酸钾 (K2CrO4) 为原料,采用电化学法制备重铬酸钾(K2Cr2O7)。制备装置如下图所示(阳离子交换膜只允许阳离子透过)下列说法错误的是
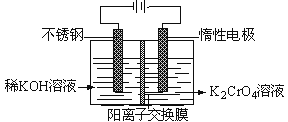
A. 阳极室中溶液的颜色逐渐由黄色变为橙色
B. 电解的过程中阳极附近溶液pH变大
C. 阴极每生成lmo1气体,电路中转移2NA个电子
D. 过程总反应的离子方程式可为4CrO42-+4H2O=2Cr2O72-+4OH-+2H2↑+O2↑
难度: 中等查看答案及解析
-
下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(H+)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
A. ①③ B. ①④ C. ②⑤ D. ②④
难度: 中等查看答案及解析
-
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是
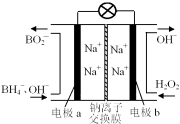
A.电池放电时Na+从b极区移向a极区
B.该电池的负极反应为:BH4-+8OH--8e-===BO2-+6H2O
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.每消耗3 mol H2O2,转移的电子为3 mol
难度: 困难查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是
A. 25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
B. 25℃时,NaB溶液的pH=8,c(Na+)- c(B-)=9.9×10-7 mol·L-1
C. 0.1 mol·L-1NaHCO3溶液:c(Na+)>c(oH-)>c(HCO3-)>c(H+)
D. 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
下列有关物质的量浓度关系正确的是
A. 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液呈酸性:c(CH3COO-)<c(CH3COOH)
B. pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C. 0.1mol·L-1的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
D. pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:c(H+)+c(M+) = c(OH-)+c(A-)
难度: 困难查看答案及解析
-
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g)
PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
50
150
250
350
n(PCl3)/mol
0
0.16
0.19
0.20
0.20
下列说法正确的是
A. 反应在前50 s的平均速率为v (PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v (正)>v (逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
难度: 困难查看答案及解析
-
某实验小组依据反应AsO43-+2H++2I- AsO33-+I2+H2O设计左下图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如右下图,下列有关叙述错误的是
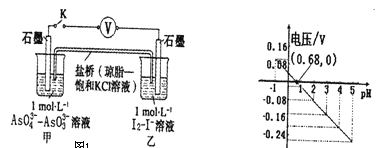
A. pH>0.68时,甲烧杯中石墨为负极
B. pH=0.68时,反应处于平衡状态
C. pH>0.68时,氧化性I2>AsO43-
D. pH=5时,负极电极反应式为2I--2e-=I2
难度: 中等查看答案及解析