-
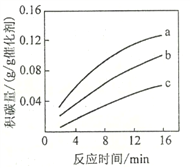
SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF—F 、S—F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
A. -1780kJ·mol-1 B. -1220 kJ·mol-1 C. -450 kJ·mol-1 D. +430 kJ·mol-1
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 凡是放热反应都是自发的,吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减小或不变
C. 熵增加且放热的反应一定是自发反应
D. 非自发反应在任何条件下都不能实现
难度: 中等查看答案及解析
-
某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是

A. 正反应活化能小于100 kJ·mol-1
B. 逆反应活化能一定小于100 kJ·mol-1
C. 正反应活化能不小于100 kJ·mol-1
D. 正反应活化能比逆反应活化能小100 kJ·mol-1
难度: 中等查看答案及解析
-
反应4A(s)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少了0.6 mol·L-1。下列叙述正确的是
A. 用A表示的反应速率是0.4 mol·(L·min)-1
B. 分别用B、C、D表示反应的速率,其比值是3∶2∶1
C. 在2 min末的反应速率,用B表示是0.3 mol·(L·min)-1
D. 在这2 min内B和C两物质的浓度都减小
难度: 简单查看答案及解析
-
在恒容条件下,能使NO2(g)+CO(g)
CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增加的措施是( )
A. 增大NO2或CO的浓度 B. 减小CO2或NO的浓度
C. 通入Ne使气体的压强增大 D. 升高反应的温度
难度: 中等查看答案及解析
-
在1L的容器中,用纯净的CaCO3与100mL稀盐酸反应制取CO2,反应生成CO2的体积随时间的变化关系如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )
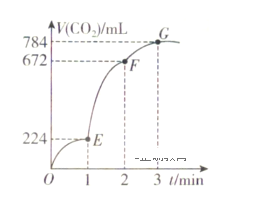
A. OE段表示的平均反应速率最快
B. F点收集到的C02的量最多
C. EF段,用盐酸表示该反应的平均反应速率为0.04mol·L-1·min-1
D. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
难度: 中等查看答案及解析
-
某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g)
H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
A.升高温度 B.加入催化剂
C.再加入n molCO和n molH2O D.再加入2n molCO2和2n molH2
难度: 困难查看答案及解析
-
可逆反应2NO2(g)
2NO(g)+O2(g)在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成nmol O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦
C. ①③④⑤ D. 全部
难度: 中等查看答案及解析
-
在室温下,0.1mol·L-1100ml的醋酸溶液中,欲使其溶液的c(H+)增大,但又要使醋酸电离程度减小,应采取( )
A. 加入少量CH3COONa固体 B. 加入少量NaOH固体
C. 提高温度 D. 加入少量纯醋酸
难度: 中等查看答案及解析
-
判断下列说法正确的是( )
A. 强电解质溶液的导电能力一定比弱电解质溶液强
B. 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠等于醋酸
C. 将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的1/2
D. 物质的量相同的磷酸钠溶液和磷酸溶液中所含的P043-量相同
难度: 中等查看答案及解析
-
如图所示,向A和B中都充人2molX和2molY,起始VA=0.8a L,VB=a L保持温度不变,在有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)
2Z(g)+W(g)达到平衡时,VA=0.9a L,则下列说法错误的是 ( )
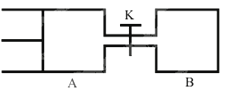
A. 两容器中达到平衡的时间A<B
B. 打开K达到新平衡后,升高B容器温度,A容器体积相比原平衡状态时一定增大
C. A容器中X的转化率为25%,且比B容器中的X的转化率小
D. 打开K一段时间达平衡时,A的体积为0.8a L(连通管中的气体体积不计)
难度: 困难查看答案及解析
-
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃
25
80
230
平衡常数
5×104
2
1.9×10﹣5
下列说法不正确的是
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 25℃时反应Ni(CO)4(g)⇌Ni(s)+4CO(g)的平衡常数为2×10﹣5
C. 80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
难度: 困难查看答案及解析
-
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
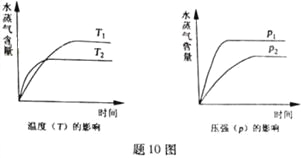
A. CO2(g)+2NH3(g)
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)
2 C6H5CH=CH2(g)+2H2O(g);△H<0
难度: 中等查看答案及解析
-
已知胆矾溶于水时溶液温度降低,室温下将1 mol无水硫酸铜制成溶液时放出热量为Q1。而胆矾分解的热化学方程式为:CuSO4·5H2O(s)===CuSO4(s)+5H2O(l);ΔH=+Q2 kJ·mol-1则Q1和Q2的关系为
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
难度: 困难查看答案及解析
-
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
选项
x
y
A
温度
容器内混合气体的密度
B
CO的物质的量
CO2与CO的物质的量之比
C
SO2的浓度
平衡常数K
D
MgSO4的质量(忽略体积)
CO的转化率
难度: 困难查看答案及解析
-
25℃时,已知弱酸的电离常数:K(CH3COOH)=1.8×10-5;K1(H2C03)=4.4×10-7, K2(H2C03)=5.6×10-11;K(HCl0)=3.0×10-8。下列说法中正确的是 ( )
A. 25℃时,0.1mol·L-1的醋酸溶液比0.Olmol·L-1 的醋酸溶液的K值小
B. 25℃时,CH3COOH溶液中加入少量NaHC03固体,醋酸的电离程度增大
C. 新制氯水与NaHC03溶液不发生反应
D. NaCl0溶液中通入少量CO2发生反应的离子方程式:2NaCl0+CO2+H2O=Na2CO3+2HCl0
难度: 中等查看答案及解析