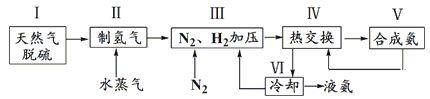
-
下列说法正确的是( )
A. 铜、石墨均能导电,所以它们均是电解质
B. NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C. 液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质
D. 蔗糖、酒精在水溶液或熔融状态下均不能导电,所以它们均是非电解质
难度: 简单查看答案及解析
-
绿色能源是指使用过程中不排放或排放极少污染物的能源,下列不属于绿色能源的是
A. 太阳能 B. 化石能源 C. 风能 D. 潮汐能
难度: 简单查看答案及解析
-
强酸和强碱的稀溶液中和热可表示为:H+(aq) + OH-(aq)=H2O(l);ΔH=-57.3kJ/mol,以下3个化学方程式中,反应热为-57.3kJ/mol的是( )
①H2SO4(aq) + 2NaOH(aq) = Na2SO4(aq) + 2H2O(l);②H2SO4(aq) + Ba(OH)2(aq) = BaSO4(s) + 2H2O(l);③NH3·H2O(aq) + HCl(aq) = NH4Cl(aq) + H2O(l)A. ① B. ② C. ③ D. 均不符合
难度: 中等查看答案及解析
-
下表中物质的分类组合完全正确的是
编号
A
B
C
D
强电解质
KNO3
H2SO4
BaSO4
HClO4
弱电解质
NH3·H2O
CaCO3
HClO
C2H5OH
非电解质
SO2
Al
H2O
CH3COOH
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
某反应过程能量变化如图所示,下列说法正确的是

A. 改变催化剂,可改变该反应的活化能
B. 该反应为放热反应,热效应等于E1-E2
C. 反应过程a有催化剂参与
D. 有催化剂条件下,反应的活化能等于E1+E2
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. (NH4)2 Fe(SO4)2 溶解于水:(NH4)2 Fe(SO4)2
2NH4+ + Fe2 + + 2SO42-
B. Al(OH)3在水中的电离:Al(OH)3
Al3 ++3OH-
C. H3PO4溶解于水:H3PO4
3H+ + PO43-
D. NaHSO3在水中的电离:HSO3- + H3O+
SO32-+ H2O
难度: 简单查看答案及解析
-
下列说法或表示方法中正确的是
A. 氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
B. 等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多
C. 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目小于0.6×6.02×1023
D. 已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸溶液与含1 mol NaOH的溶液混合,放出的热量要小于57.3 kJ
难度: 中等查看答案及解析
-
下列有关化学反应速率的说法中,正确的是
A. 100 mL 1 mol/L的稀硫酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B. 合成氨的反应是一个放热反应,所以升高温度,反应速率减慢
C. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
D. 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
难度: 中等查看答案及解析
-
关节炎的成因是在关节滑液中形成尿酸钠晶体——NaUr,其平衡关系为:Ur—(aq)+Na+(aq)
NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
A. 形成尿酸钠晶体的反应为放热反应 B. 形成尿酸钠晶体的反应为吸热反应
C. 尿酸钠溶解度较大 D. 尿酸钠晶体一定难溶于水
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A. 在25℃、101 kPa时,2 gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧热的热化学方程式为:2H2(g)+O2(g)
2H2O(l);ΔH=-285.8kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)
2CO(g)+O2(g);ΔH=+283.0 kJ/mol
C. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH =-57.3 kJ·mol—1,若将含0.5 mol H2SO4的稀硫酸与1 mol NaOH固体混合,放出的热量大于57.3 kJ
D. 已知C(石墨,s)
C(金刚石,s);ΔH=+1.9 kJ/mol,则金刚石比石墨稳定
难度: 中等查看答案及解析
-
已知反应Na2S2O3+H2SO4 = S↓+SO2↑+H2O,下列各组实验中反应最快的是
组号
反应温度
(℃)
参加反应的物质
水体积(mL)
Na2S2O3
H2SO4
体积(mL)
浓度(mol·L-1)
体积(mL)
浓度(mol·L-1)
A
10
5
0.1
10
0.1
5
B
10
5
0.1
5
0.1
10
C
30
5
0.1
5
0.1
10
D
30
5
0.2
5
0.2
10
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是
A. 非自发反应在任何条件下都不能发生
B. 冰融化为水的过程中ΔH < 0,ΔS > 0
C. 2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1 此反应在低温时可以自发进行
D. 知道了某过程有自发性之后,可预测过程发生完成的快慢
难度: 简单查看答案及解析
-
对于下列各组反应,反应开始时,产生氢气速率最快的是
A. 70℃,将0.1 mol 镁粉加入到10 mL 6 mol·L-1 的硝酸溶液中
B. 60℃,将0.2 mol 镁粉加入到20 mL 3 mol·L-1 的盐酸溶液中
C. 60℃,将0.2 mol 铁粉加入到10 mL 3 mol·L-1 的盐酸溶液中
D. 60℃,将0.1 mol 镁粉加入到10 mL 3 mol·L-1的硫酸溶液中
难度: 中等查看答案及解析
-
下列关于能量判据和熵判据的说法中,不正确的是
A. 放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程
B. 放热过程(ΔH<0)或熵增加(ΔS>0)的过程一定是自发的
C. 在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200 K)下则能自发进行
D. 由能量判据(以焓变为基础)和熵判据组合成的复合判据,将更适合于所有的过程
难度: 困难查看答案及解析
-
下列说法不能够用勒夏特勒原理来解释的是
A. 实验室用排饱和食盐水的方法收集氯气
B. 溴水中有下列平衡Br2+H2O
HBr+HBrO,当加入硝酸银溶液后(AgBr是淡黄色沉淀),溶液颜色变浅
C. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 恒温、恒压条件下,在2NO2
N2O4平衡体系中充入He后,体系颜色变浅
难度: 困难查看答案及解析
-
25 ℃时,把0.2 mol·L-1的醋酸加水稀释,则图中的纵轴y表示的是
A. 溶液中H+的物质的量
B. 溶液的导电能力
C. 溶液中的c(CH3COO-)/c(CH3COOH)
D. CH3COOH的电离程度
难度: 中等查看答案及解析
-
80 ℃时,2 L密闭容器中充入0.40 mol N2O4,发生反应N2O4(g)
2NO2(g) ΔH=+53 kJ/mol,获得如下数据。下列判断正确的是
时间/s
0
20
40
60
80
100
c(NO2)/mol·L-1
0.00
0.12
0.20
0.26
0.30
0.30
A. 升高温度该反应的平衡常数K减小
B. 该反应的 ΔS <0
C. 反应达平衡时吸热15.9 kJ
D. 100 s时再通入0.40 mol N2O4,达新平衡时N2O4的体积分数减小
难度: 困难查看答案及解析
-
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项
x
y
A
温度
容器内混合气体的密度
B
CO的物质的量
CO2与CO的物质的量之比
C
SO2的浓度
平衡常数K
D
MgSO4的质量(忽略体积)
CO的转化率
难度: 困难查看答案及解析
-
一定温度下,在容积恒定的密闭容器中发生可逆反应A(g)+3B(g)
2C(g),下列叙述一定是达到平衡的标志的是
①2υ(B)正=3υ(C)逆;②单位时间内生成a mol A,同时消耗2a mol C;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤C的质量分数不再改变;⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2的状态;⑦A、B、C的浓度彼此相等;⑧混合气体的密度不再改变的状态
A. ①③④⑤ B. ①④⑤⑦ C. ④⑤⑥⑧ D. ③⑤⑥⑦
难度: 中等查看答案及解析
-
汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体,反应方程式为4CO(g)+2NO2(g)
4CO2(g)+N2(g) ΔH=-1200kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是
A.
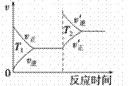 B.
B. 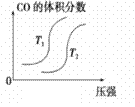 C. C
C. CD.
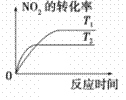
难度: 中等查看答案及解析
-
已建立平衡的可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的百分含量一定增加; ②生成物的产量一定增加;
③反应物的转化率一定增加; ④反应物物质的量浓度一定减小;
⑤正反应速率一定大于逆反应速率; ⑥使用了催化剂
A.①② B.②⑤ C.③⑤ D.③④⑥
难度: 困难查看答案及解析
-
某恒定温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)
4C(?)+2D(?),“?”代表状态不确定。5 min后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为15∶14,则下列说法正确的是
A. 该反应的化学平衡常数表达式是K=[c4(C)·c2(D)]/[c3(A)·c2(B)]
B. 0~5 min内A的反应速率为0.24 mol·L-1·min-1
C. 此时B的平衡转化率是40%
D. 增大该体系的压强,平衡向右移动,化学平衡常数增大
难度: 困难查看答案及解析
-
下列图示与对应的叙述不相符的是
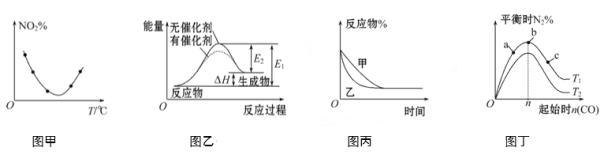
A. 图甲表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH<0
B. 图乙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
C. 图丙表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(g)的影响,则P乙>P甲
D. 图丁表示反应:4CO(g)+2NO2(g)
N2(g)+4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,平衡常数K1>K2
难度: 困难查看答案及解析
-
已知在一定温度下,一定体积的密闭容器里存在如下平衡:2SO2(g)+O2(g)
2SO3(g),若开始时充入2 mol SO3,达到平衡时混合气体的压强比起始时增大了10%;若开始时充入2 mol SO2和1 mol O2,则达到平衡时SO2的转化率为
A. 20% B. 60% C. 80% D. 90%
难度: 困难查看答案及解析
-
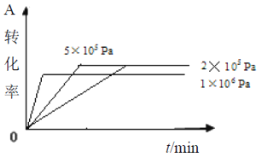
在容积可变的密闭容器中充入2 mol A和1 mol B发生反应:mA(g) + nB(g)
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
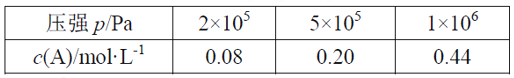
A. 维持压强2×105Pa,若反应开始后5min时达到平衡,则v(A)=0.016mol/(L·min)
B. P从2×105Pa增加到5×105Pa时,平衡逆向移动
C. P为1×106Pa时,平衡常数表达式K=
D. 其它条件相同时,在上述三个压强下分别发生该反应。A的转化率随时间变化曲线如图所示
难度: 困难查看答案及解析