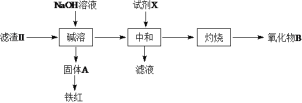
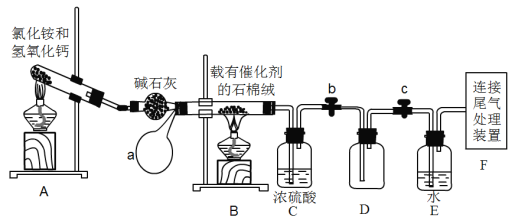
-
下列有关热化学方程式的叙述正确的是
A. 已知甲烷的燃烧热为890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C. 已知中和热为ΔH=-57.3 kJ/mol,则1 mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D. 已知S(g)+O2(g)=SO2(g) ΔH1;S(s)+O2(g)=SO2(g) ΔH2,则ΔH1<ΔH2
难度: 中等查看答案及解析
-
下列说法错误的是
A. 石墨烯作为一种复杂的无机高分子,是重要的隐身材料,我国对石墨烯的研究已处于世界领先地位
B. 明矾在水中生成的氢氧化铝胶体有吸附性,因此常用明矾对水进行消毒
C. 2017年我国北方地区相继开展了“煤改气”和“煤改电”的尝试,此举是改善空气质量的重要措施
D. 高科技产业中的压电陶瓷及生物陶瓷属于新型无机非金属材料
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述不正确的是
A. 某温度和压强下,22.4 L CO和N2的混合气体中含有的原子总数可能为2NA
B. 在合成氨反应中,当有2.24 L氨气(标准状况下)生成时,转移的电子数为0.3NA
C. 1 L 1 mol/L Na2CO3水溶液中含有的氧原子数为3NA
D. 将78 g Na2O2与过量CO2反应转移的电子数为NA
难度: 中等查看答案及解析
-
既能表现出酸性又能表现出碱性的化合物为两性化合物,下列物质为两性化合物的是①SiO2 ②Al2O3 ③KAl(SO4)2 ④Ca(HCO3)2 ⑤(NH4)2CO3 ⑥Al
A. ①②③④⑤⑥ B. ①②④⑤ C. ②④⑤⑥ D. ②④⑤
难度: 简单查看答案及解析
-
在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(s)+3B(g)
2C(g)+D(g)已达平衡状态的是
A. 混合气体的压强 B. 混合气体的密度 C. 体系的温度 D. 气体的总物质的量
难度: 简单查看答案及解析
-
常温下,下列各组无色离子在指定溶液中一定能大量共存的是
A. c(ClO-)=1.0 mol/L的溶液:Na+、Cu2+、SO32-、SO42-
B. 与金属铝产生气体的溶液中:Al3+、HCO3-、Cl-、SO42-
C. 水电离产生的c(H+)=10-13 mol/L的溶液中:Na+、K+、Cl-、NO3-
D. 0.1 mol/L FeSO4溶液中:H+、NH4+、NO3-、Cl-
难度: 中等查看答案及解析
-
对于300 mL 1 mol/L 盐酸与金属铁制氢气的反应,下列措施能提高反应速率的是
①升温 ②改用100 mL 3 mol/L盐酸 ③改用铁粉替代铁片 ④加入一定量浓硝酸 ⑤再加入300 mL 1 mol/L盐酸 ⑥将盐酸改用浓硫酸 ⑦加入少量CuSO4溶液
A. ①②③④⑤⑥⑦ B. ①②③⑤⑥⑦ C. ①②③⑦ D. ①②③
难度: 中等查看答案及解析
-
恒温条件下,欲使CH3COONa溶液中c(CH3COO-)/c(Na+)的比值增大,可在溶液中加入下列物质中正确的是①固体NaOH ②固体KOH ③固体NaHS ④固体CH3COONa ⑤冰醋酸 ⑥加水
A. ②③④⑤ B. ②④⑤ C. ②⑤⑥ D. ①⑤⑥
难度: 中等查看答案及解析
-
某温度下,体积相同的甲、乙两容器中,分别充有等物质的量的SO3气体,在相同温度下发生反应2SO3(g)
O2(g)+2SO2(g)并达到平衡。在这一过程中甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO3的转化率为P%,则乙容器中SO3的转化率
A. 等于P% B. 大于P% C. 小于P% D. 无法比较
难度: 中等查看答案及解析
-
用下列实验装置进行相应的实验,不能达到实验目的的是
A
B
C
D
装置
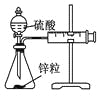
实验
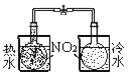
结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢
证明温度对化学平衡的影响
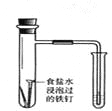
验证铁钉发生吸氧腐蚀
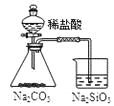
可证明非金属性Cl>C>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
B. 少量SO2气体通入NaClO溶液中:SO2+ClO-+H2O=SO42-+2H++Cl-
C. NaHSO4溶液与Ba(OH)2溶液反应后溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
D. 足量锌粉与一定量浓硫酸反应:Zn+2H2SO4=Zn2++SO42-+SO2↑+2H2O
难度: 中等查看答案及解析
-
某温度下,一定体积的氯气与1 L 1.5 mol/L NaOH溶液恰好完全反应,若产物中NaClO和NaClO3的物质的量之比为1:3,则被还原的氯气的物质的量为
A. 0.15 mol B. 0.3 mol C. 0.6 mol D. 0.8 mol
难度: 中等查看答案及解析
-
某新型电池,负极是疏松多孔的石墨电极,金属锂原子填充在石墨电极的孔隙中。正极是惰性电极,参与反应的物质是二氯亚砜(SOCl2),且正极有刺激性气味气体产生。该电池的电解质为固体。下列说法正确的是
A. 负极发生还原反应,当有1 mol电子发生转移时,负极质量减少7 g
B. 若该电池固体电解质中起导电作用主要是Li+,放电过程中Li+向负极移动
C. 用该电池电解饱和食盐水,两极材料均为惰性电极,若放电过程中消耗1 mol锂,则理论上两极各产生气体11.2 L
D. 正极产生的刺激性气味气体为SO2
难度: 中等查看答案及解析
-
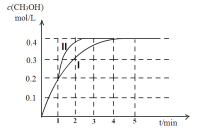
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。微粒物质的量的变化如图所示。下列说法正确的是
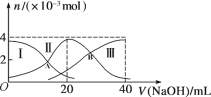
A. 当V(NaOH)=20 mL时,溶液中离子浓度关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B. 当V(NaOH)=30 mL时,则有:2c(H+) + c(HA-) + 2c(H2A) = c(A2-) + 2c(OH-)
C. 向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH减小
D. 若A、B两点对应的溶液pH值分别为a、b,则H2A
2H++A2-的K=10-a-b
难度: 中等查看答案及解析
-
室温下进行的下列实验,不能达到预期目的是
实验内容
实验目的
A
向同体积同浓度H2O2溶液中,分别加入1 mol/L的CuCl2、FeCl3溶液
比较Cu2+、Fe3+对H2O2分解速率的影响
B
向Mg(OH)2浊液中滴加少量0.1 mol/L FeCl3溶液
比较Mg(OH)2和Fe(OH)3的溶解度
C
将SO2通入酸性高锰酸钾溶液中
探究SO2的还原性
D
测定相同浓度的NaClO溶液,CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
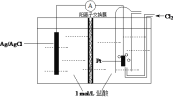
A. 负极反应为Ag-e-+Cl-=AgCl
B. 放电时,交换膜右侧溶液中pH升高
C. 当电路中转移0.1 mol e-,通过交换膜的阳离子为0.2 mol
D. 用KCl溶液代替盐酸,则电池总反应改变
难度: 中等查看答案及解析