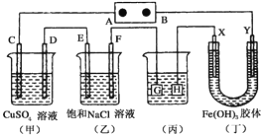
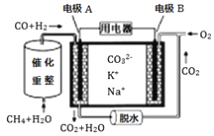
-
关于镀铜和电解精炼铜,下列说法中正确的是( )
A. 都用粗铜作阳极、纯铜作阴极
B. 电解液的成分都保持不变
C. 阳极反应都只有Cu-2e-=Cu2+
D. 阴极反应都只有Cu2++2e-=Cu
难度: 中等查看答案及解析
-
下列事实不能证明HNO2是弱酸的是( )
A. 0.1mol·L-1的HNO2溶液的pH=2 B. 用HNO2溶液做导电性实验时,灯泡很暗
C. 常温下NaNO2溶液的pH>7 D. pH=4的HNO2溶液稀释100倍后,pH<6
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3
B.向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl3饱和溶液可制备Fe(OH)3胶体
C.等体积pH=12的氨水和pH=12的NaOH溶液可中和含等物质的量HCl的盐酸
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用酸去除
难度: 中等查看答案及解析
-
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由强到弱的顺序是
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
难度: 中等查看答案及解析
-
如图下列装置中Fe腐蚀由快到慢的顺序为( )
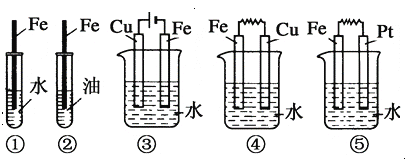
A. ⑤ ④ ③ ② ①
B. ⑤ ④ ① ② ③
C. ⑤ ③ ④ ① ②
D. ① ② ④ ③ ⑤
难度: 中等查看答案及解析
-
已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) △H= +255.6kJ·mol-1
b.CH3CH2OH(g)+1/2O2(g)==3H2(g)+2CO(g) △H= +13.8kJ·mol-1
则下列说法不正确的是
A. 降低温度,可提高b路线中乙醇的转化率
B. 从能量消耗的角度来看,b路线制氢更加有利
C. 乙醇可通过淀粉等生物原料发酵制得,属于可再生资源
D. 由a、b知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ·mol-1
难度: 中等查看答案及解析
-
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3主要:Cu2++CO32─+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32─=CuCO3↓
(2)CuSO4+Na2S主要:Cu2++S2─=CuS↓
次要:Cu2++S2─+2H2O=Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是( )
A. CuS <Cu(OH)2<CuCO3 B. CuS >Cu(OH)2>CuCO3
C. Cu(OH)2>CuCO3>CuS D. Cu(OH)2<CuCO3<CuS
难度: 简单查看答案及解析
-
常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5、Ksp(AgCl)=1.8×10-10、Ksp(AgI)=8.3×10-17。下列有关说法中,错误的是( )
A. 常温下,Ag2SO4、AgCl、AgI在水中的溶解能力依次减弱
B. 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C. Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D. 在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出
难度: 中等查看答案及解析
-
Mg—H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
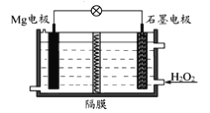
A. Mg电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH增大
D. 溶液中Cl-向正极移动
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4+ 8H2O
3Zn(OH)2+ 2Fe(OH)3+ 4KOH下列叙述不正确的是( )
A. 放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+ 5 OH-= FeO42-+ 4H2O
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
难度: 简单查看答案及解析
-
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是( )

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为O2+2H2O+4e-===4OH-
C. 每转移0.1 mol电子,便消耗1.12 L的O2
D. H+由a极通过固体酸电解质传递到b极
难度: 困难查看答案及解析
-
将右图实验装置的 K 闭合,下列判断正确的是( )
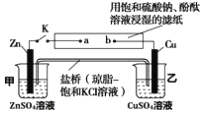
A. 电子沿 Zn→a→b→Cu 路径流动
B. Cu 电极上发生还原反应
C. 片刻后甲池中c(SO42-)增大
D. 片刻后可观察到滤纸b点变红色
难度: 中等查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O===CH3COOH+4H+。下列有关说法正确的是( )
A. 检测时,电解质溶液中的H+向负极移动
B. 若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C. 电池反应的化学方程式为:CH3CH2OH+O2===CH3COOH+H2O
D. 正极上发生的反应为:O2+4e-+2H2O===4OH-
难度: 简单查看答案及解析
-
某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
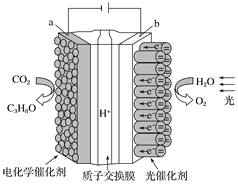
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 g CO2被还原
D. a电极的反应为3CO2+18H+-18e-===C3H8O+5H2O
难度: 中等查看答案及解析
-
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示(上端为多孔电极a,下断为多孔电极b),该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法不正确的是

A.工作时电极b作正极,O2-由电极b流向电极a
B.工作时电子由电极a通过介质流向电极b
C.负极的电极反应式为:CO+O2—―2e-=CO2
D.传感器中通过的电流越大,尾气中CO的含量越高
难度: 中等查看答案及解析
-
用石墨作电极电解3 mol·L-1KCl和0.5 mol·L-1Al2(SO4)3的1 L混合溶液时,下图电解变化曲线合理的是( )

A B C D
A. A B. B C. C D. D
难度: 中等查看答案及解析