-
下列物质或物质的主要成分对应化学式错误的是
A. 铜绿-Cu2(OH)2CO3 B. 芒硝-NaNO3·10H2O
C. 漂粉精-Ca(ClO)2 D. 水玻璃-Na2SiO3
难度: 简单查看答案及解析
-
下列关于胶体的说法中正确的是
A. 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
B. 胶体具有介稳性,是因为胶体带电荷
C. 长江入海口附近形成泥沙三角洲是因为河水中的土壤胶体粒子聚沉导致
D. 向鸡蛋清胶体中加入硫酸铜溶液,可使其中的蛋白质盐析。
难度: 简单查看答案及解析
-
下列各组离子一定可以大量共存的是
A. 澄清透明溶液中:K+、Cu2+、ClO-、S2-
B. 能与铝粉反应生成氢气的溶液中:Na+、Fe3+、NO3-、SO42-
C. c(Al3+)=0.1mol/L的溶液中:K+、Mg2+、SO42-、AlO2-
D. c(Fe3+)=1 mol·L-1的溶液中:Mg2+、H+、MnO4-、SO42-
难度: 中等查看答案及解析
-
下列说法中正确的是
A. “地沟油”禁止食用,但可以用来制肥皂及生物柴油
B. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
C. 向牛奶中加入果汁会产生沉淀,是因为发生了中和反应
D. 海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化
难度: 简单查看答案及解析
-
硫代硫酸钠溶液常用于氯气泄漏的喷洒剂,具有非常好的处理效果,其与氯气能发生反应:Na2S2O3+4Cl2+5H2O=2NaCl+6HCl+2H2SO4。下列说法错误的是( )
A. Na2S2O3在该反应中做还原剂
B. 处理氯气时当Na2S2O3过量时,喷洒后的溶液中会出现浑浊的现象
C. 1molNa2S2O3与氯气完全反应转移电子4mol
D. 氧化产物与还原产物的物质的量之比为1:4
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 12 g金刚石中含有碳碳键的数目为2NA
B. 粗铜精炼时阳极质量减少6.4g,则外电路上通过0.2NA电子
C. 32g铜与过量浓硫酸完全反应,生成的气体分子数小于0.5NA
D. 100 g质量分数为17%的H2O2水溶液中含氧原子数目为NA
难度: 中等查看答案及解析
-
W、X、Y、Z、R为原子序数依次增大的短周期主族元素,W元素的一种核素可用于鉴定文物年代,X元素的一种单质可作为饮用水消毒剂,Y元素的简单离子是同周期元素中半径最小的,Z和W同主族,R元素被称为“成盐元素”,下列说法中错误的是
A. W和X形成WX2的化合物属于非极性分子
B. 工业上常用电解熔融Y和R化合物的方法制取单质Y
C. 日常生活中所使用的计算机芯片需要消耗大量单质Z
D. 元素X和R形成的某些化合物可用于净水
难度: 困难查看答案及解析
-
下列有关实验描述错误的是
A. 取少量某无色弱酸性溶液,加入过量NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则该溶液中一定含有NH4+
B. 乙酸乙酯制备实验中,要将导管口插入饱和碳酸钠溶液底部,以利于分离乙酸乙酯
C. 为证明苯环结构中是否含有双键,可向苯中加入一定量酸性高锰酸钾
D. 除去CO2中混有的H2S,可将混合气体通过足量酸性高锰酸钾溶液
难度: 中等查看答案及解析
-
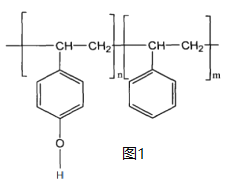
某有机物的结构如图所示,下列有关该有机物说法正确的是
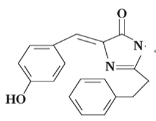
A. 该有机物属于芳香烃化合物
B. 分子式为C18H17O2N2
C. 该有机物能与新制的氢氧化铜悬浊液反应生成砖红色沉淀
D. 该有机物能使少量酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
铅蓄电池是目前常见的二次电池,其放电时总反应为Pb + PbO2 + 2H2SO4 =2PbSO4 + 2H2O。下列说法中正确的是
A. 放电时,Pb作为电池的负极发生还原反应
B. 放电时,内电路中的H+ 向Pb电极移动
C. 充电时,外接电源的负极需要与Pb电极相连
D. 充电时,阳极区附近溶液酸性减弱
难度: 中等查看答案及解析
-
已知合成氨的热化学方程式为:N2(g)+ 3H2(g)
2NH3(g)△H=-92kJ/mol,下列说法中正确的是
A. 当1molN2与3molH2充分反应,可放出92kJ热量
B. 恒容恒温发生该反应时,向容器中充入少量He,反应速率加快且平衡正向移动
C. 恒压恒温发生该反应时,向容器中充入少量He,反应速率不变且平衡不移动
D. 升高温度时,正、逆反应速率都加快,而逆反应速率增加更多
难度: 中等查看答案及解析
-
常温下,用0.01000 mol·L-1的盐酸滴定0.01000 mol·L-1NaA溶液20.00mL。滴定曲线如图所示,下列说法错误的是( )
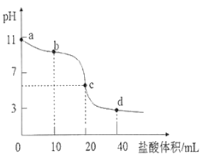
A. 当滴入盐酸以后,c(HA)+c(A-)<0.01000 mol·L-1
B. b点溶液中微粒浓度大小关系为:c(HA)>c(A-)>c(Cl -)>c(OH-)>c(H+)
C. c点时,溶液中微粒浓度关系为:c(Na+)<c(HA)+2c(A-)
D. d点时,溶液中微粒浓度存在关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(A-)
难度: 中等查看答案及解析
-
下表实验、现象和结论均正确的是
选项
实验
现象
结论
A
向浓度均为0.lmol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)<Ksp(AgI)
B
向某溶液中滴加足量稀硫酸
溶液中出现了气泡和淡黄色浑浊
溶液中可能含有S2O32-
C
常温下,用pH试纸测定等物质的量浓度的NaCN和NaClO溶液pH
前者的 pH比后者的大
水解程度:CN-<ClO-
D
向FeCl3和KSCN混合溶液中,加入少量KCl的固体(已知FeCl3 +KSCN
Fe(SCN)3+3KCl)
溶液颜色变浅
平衡向逆反应方向移动
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
TiO2是制取航天工业材料——钛合金的重要原料。为测定纯度,称取上述TiO2试样0.2g,一定条件下将TiO2溶解并还原为Ti3+,得到待测液约30mL,再用0.1 mol·L-1NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+(假设杂质不参与以上反应)。下列说法中错误的是( )
A. 欲配制0.1 mol·L-1NH4Fe(SO4)2标准溶液400mL,需要NH4Fe(SO4)2固体质量13.3g
B. 再进行滴定之前,应向锥形瓶中的待测样品滴加几滴KSCN溶液做指示剂
C. 滴定前仰视读数,滴定结束后俯视读数,将导致测定结果偏大
D. 在其他滴定实验操作均正确时,消耗标准液20.00mL,则样品的纯度为80%
难度: 困难查看答案及解析