-
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是 。
(2)调节pH,实验记录如下:
实验
pH
现象
A
10
产生白色沉淀,稍后溶解,溶液澄清
B
6
产生白色沉淀,一段时间后,沉淀未溶解
C
2
产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据实验现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:
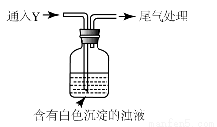
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
高三化学实验题简单题查看答案及解析
-
(15分)某学生对Na2SO3与AgNO3在不同PH下的反应进行探究。
(1)测得Na2SO3溶液PH=11,AgNO3溶液PH=5,二者水解的离子分别是 。
(2)调节PH,实验记录如下:

查阅资料得知:
i.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
ii.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将中滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据上述现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如下:
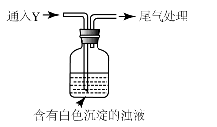
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
高三化学实验题极难题查看答案及解析
-
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得0.1mol/L的Na2SO3溶液pH=11,其原因是___________(用离子方程式解释)
(2)调节pH,对两者的反应进行了如下实验并记录了实验现象(实验都在锥形瓶中完成,且所用锥形瓶均进行振荡)
实验
pH
实验现象
1
10
产生白色沉淀,稍后溶解,溶液澄清
2
6
产生白色沉淀,放置长时间后无变化
3
2
产生白色沉淀,一段时间后,变为棕黑色海绵状沉淀X
已知:
A.Ag2SO3:白色不溶于水,能溶于过量Na2SO3溶液
B.Ag2SO4:白色微溶于水,只能溶于浓硝酸
C.Ag2O:棕黑色,能与酸反应
①根据以上信息,解释实验1中白色沉淀溶解可能的原因___________
②甲同学对于实验2中的白色沉淀的成分,提出如下猜想
猜想1:白色沉淀为Ag2SO3
猜想2:白色沉淀为Ag2SO4
猜想3:白色沉淀中既有Ag2SO3也有Ag2SO4
为了证明其猜想,甲同学过滤实验2中的白色沉淀,加入_________溶液,发现白色沉淀部分溶解;再将剩余固体过滤出来,加入_________溶液,沉淀完全溶解,由此证明猜想3成立。
(3)乙同学为了确定实验3中棕黑色沉淀X的成分,做了如下实验
①向X中加入稀盐酸,无明显变化
②向X中加入过量浓硝酸,有红棕色气体生成
③分别用Ba(NO3)2溶液和BaCl2溶液检验实验②反应后的溶液,发现前者无变化,后者产生白色沉淀,其中,实验①的目的为___________,由上述实验现象可确定沉淀X的成分为___________(填化学式),实验②的化学方程式为___________。
高三化学实验题困难题查看答案及解析
-
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号
pH
实验现象
a
10
产生白色沉淀,稍后溶解,溶液澄清
b
6
产生白色沉淀,一段时间后,沉淀未溶解
c
2
产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
高三化学实验题中等难度题查看答案及解析
-
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号
pH
实验现象
a
10
产生白色沉淀,稍后溶解,溶液澄清
b
6
产生白色沉淀,一段时间后,沉淀未溶解
c
2
产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
高三化学实验题中等难度题查看答案及解析
-
某学生对Na2SO3 与AgNO3在不同pH下的反应进行探究,过程如下:
(1)调节pH,实验记录如下:
实验
pH
现象
a
10
产生白色沉淀,稍后溶解,溶液澄清
b
6
产生白色沉淀,一段时间后,沉淀未溶解
c
2
产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X
查阅资料得知:
I.Ag2SO3: 白色,难溶于水,溶于过量Na2SO3 的溶液
II.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a 中白色沉淀为Ag2SO3,离子方程式是____________________________。
②推测a 中白色沉淀为Ag2SO4,推测的依据是_________________________________。
(2)取b、c 中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4 固体置于_________溶液中,未溶解。
(3)将X 从溶液中滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
II.向X 中加入过量浓HNO3,产生红棕色气体
III.用Ba(NO3)2溶液、BaCl2溶液检验II中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是_________________________。
②根据上述现象,分析X的性质和元素组成是__________________________。
③II 中反应的化学方程式是________________________。
(4)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,SO32-还原性增强,并通过进一步实验确认了这种可能性,实验装置如图所示:
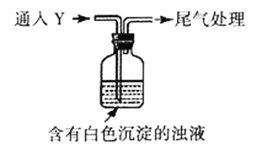
①气体Y 是__________________。
②白色沉淀转化为X 的化学方程式是__________________________。
高三化学综合题中等难度题查看答案及解析
-
Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
实验Ⅰ 配制500 mL 一定浓度的Na2SO3溶液
①溶【解析】
准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是____②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为 __,同时洗涤____(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2 cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
实验Ⅱ 探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(1)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式 ____;
②提出假设二的可能依据是_____;
③验证假设三是否成立的实验操作是____。
(2)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:

①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为____;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是____(写化学式)。
(3)由上述实验可知,盐溶液间的反应存在多样性。经验证,(1)中实验假设一成立,则(2)中实验的产物不同于(1)实验的条件是 ___。
高三化学实验题中等难度题查看答案及解析
-
Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
I.(1)配制500mL一定浓度的Na2SO3溶液
①溶【解析】
准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是___。②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为_,同时洗涤___(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
Ⅱ.探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(2)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式__;
②提出假设二的可能依据是___;
③验证假设三是否成立的实验操作是__。
(3)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:

①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为___;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是__(写化学式)。
(4)由上述实验可知,盐溶液间的反应存在多样性。经验证,(2)中实验假设一成立,则(3)中实验的产物不同于(2)实验的条件是__。
高三化学实验题中等难度题查看答案及解析
-
某化学小组对Na2SO3和AgNO3在不同pH下的反应及产物,进行了以下实验探究。
查阅资料:
Ⅰ.Ag2SO3:白色、难溶于水;
Ⅱ.Ag2O:棕黑色、难溶于水,易与酸溶液反应。
(1)根据资料:①通常情况Na2SO3溶液和AgNO3溶液反应产生的现象是________。
②若Ag2O与盐酸反应,其化学方程式应为___________。
(2)检测溶液pH:①0.1mol/LAgNO3溶液的pH=5,引发这一结果的微粒是________。
②0.1mol/LNa2SO3溶液的pH=10,其原因用离子方程式解释是________。
(3)实验探究:在不同pH条件下Na2SO3溶液与AgNO3溶液混合反应。
实验记录如下:

Ⅰ.实验a中沉淀溶解消失的原因,可能是___________。
Ⅱ.Ag2SO3在溶液中沉淀析出的大致pH范围是_________。
Ⅲ.将d中棕黑色絮状物X滤出、洗净、进行实验分析:
实验
操作
现象
ⅰ
将其置于试管中加稀盐酸、观察
无明显现象
ⅱ
将其置于试管中加足量浓硝酸、观察
立即产生红棕色气体
ⅲ
在ⅱ反应所得溶液中,加Ba(NO3) 2溶液、观察,再加BaCl2、观察
前者无明显现象,后者出现白色沉淀
①由实验ⅰ得出的结论是_________。
②d中的棕黑色絮状物X是_________。
③实验ⅱ中的化学反应方程式是___________。
(4)小组认为在酸性条件下,SO32-的________性增强,生成X的化学方程式是______。
高三化学实验题困难题查看答案及解析
-
某学生对Na2S03与AgN03在不同pH下的反应进行探究
(1)测得Na2S03溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是__________;
(2)调节pH,实验记录如下:
实验
pH
现象
a
10
产生白色沉淀,稍后溶解,溶液澄清
b
6
产生白色沉淀,一段时间后,沉淀未溶
c
2
产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
②Ag2O棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为 。
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为 。
该同学设计实验确认了 a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀, 置于Na2SO3溶液中,沉淀溶解。另取Ag2SO4固体置于足量 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向x中加人过量浓HNO3,产生红棕色气体。
Ⅲ.用 Ba(NO3)2 溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀.
①实验I的目的是 。
②根据实验现象,分析X是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,+4价硫的还原性增强,能被+1价银氧化。通过进一步实验确认了这种可能性,实验如下:

①通人Y后,瓶中白色沉淀转化为棕黑色,气体Y是 。
②白色沉淀转化为X的化学方程式是 。
高三化学实验题极难题查看答案及解析