-
某学生对Na2S03与AgN03在不同pH下的反应进行探究
(1)测得Na2S03溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是__________;
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
②Ag2O棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为 。
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为 。
该同学设计实验确认了 a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀, 置于Na2SO3溶液中,沉淀溶解。另取Ag2SO4固体置于足量 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向x中加人过量浓HNO3,产生红棕色气体。
Ⅲ.用 Ba(NO3)2 溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀.
①实验I的目的是 。
②根据实验现象,分析X是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,+4价硫的还原性增强,能被+1价银氧化。通过进一步实验确认了这种可能性,实验如下:

①通人Y后,瓶中白色沉淀转化为棕黑色,气体Y是 。
②白色沉淀转化为X的化学方程式是 。
-
某学生对Na2S03与AgN03在不同pH下的反应进行探究
(1)测得Na2S03溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是__________;
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
②Ag2O棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为 。
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为 。
该同学设计实验确认了 a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀, 置于Na2SO3溶液中,沉淀溶解。另取Ag2SO4固体置于足量 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向x中加人过量浓HNO3,产生红棕色气体。
Ⅲ.用 Ba(NO3)2 溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀.
①实验I的目的是 。
②根据实验现象,分析X是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,+4价硫的还原性增强,能被+1价银氧化。通过进一步实验确认了这种可能性,实验如下:
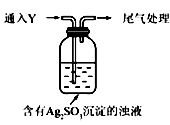
①通人Y后,瓶中白色沉淀转化为棕黑色,气体Y是 。
②白色沉淀转化为X的化学方程式是 。
-
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
| 实验序号 | pH | 实验现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
-
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
| 实验序号 | pH | 实验现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
-
某学生对Na2SO3 与AgNO3在不同pH下的反应进行探究,过程如下:
(1)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
I.Ag2SO3: 白色,难溶于水,溶于过量Na2SO3 的溶液
II.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a 中白色沉淀为Ag2SO3,离子方程式是____________________________。
②推测a 中白色沉淀为Ag2SO4,推测的依据是_________________________________。
(2)取b、c 中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4 固体置于_________溶液中,未溶解。
(3)将X 从溶液中滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
II.向X 中加入过量浓HNO3,产生红棕色气体
III.用Ba(NO3)2溶液、BaCl2溶液检验II中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是_________________________。
②根据上述现象,分析X的性质和元素组成是__________________________。
③II 中反应的化学方程式是________________________。
(4)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,SO32-还原性增强,并通过进一步实验确认了这种可能性,实验装置如图所示:
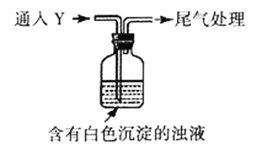
①气体Y 是__________________。
②白色沉淀转化为X 的化学方程式是__________________________。
-
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是 。
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据实验现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:
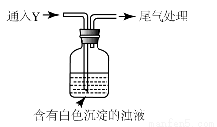
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
-
(15分)某学生对Na2SO3与AgNO3在不同PH下的反应进行探究。
(1)测得Na2SO3溶液PH=11,AgNO3溶液PH=5,二者水解的离子分别是 。
(2)调节PH,实验记录如下:

查阅资料得知:
i.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
ii.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将中滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据上述现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如下:
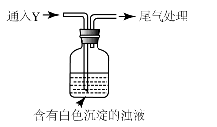
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
-
下列说法正确的是
A.向Na2S03溶液中加入硝酸酸化的BaCl2,有白色沉淀出现,说明Na2S03溶液已经变质
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.等体积、pH都为3的酸HCl和CH3COOH分别与足量的锌反应,放出的氢气一样多
D.硫酸铁可用于净水,因为三价铁离子可水解生成Fe(OH)3沉淀
-
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得0.1mol/L的Na2SO3溶液pH=11,其原因是___________(用离子方程式解释)
(2)调节pH,对两者的反应进行了如下实验并记录了实验现象(实验都在锥形瓶中完成,且所用锥形瓶均进行振荡)
| 实验 | pH | 实验现象 |
| 1 | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| 2 | 6 | 产生白色沉淀,放置长时间后无变化 |
| 3 | 2 | 产生白色沉淀,一段时间后,变为棕黑色海绵状沉淀X |
已知:
A.Ag2SO3:白色不溶于水,能溶于过量Na2SO3溶液
B.Ag2SO4:白色微溶于水,只能溶于浓硝酸
C.Ag2O:棕黑色,能与酸反应
①根据以上信息,解释实验1中白色沉淀溶解可能的原因___________
②甲同学对于实验2中的白色沉淀的成分,提出如下猜想
猜想1:白色沉淀为Ag2SO3
猜想2:白色沉淀为Ag2SO4
猜想3:白色沉淀中既有Ag2SO3也有Ag2SO4
为了证明其猜想,甲同学过滤实验2中的白色沉淀,加入_________溶液,发现白色沉淀部分溶解;再将剩余固体过滤出来,加入_________溶液,沉淀完全溶解,由此证明猜想3成立。
(3)乙同学为了确定实验3中棕黑色沉淀X的成分,做了如下实验
①向X中加入稀盐酸,无明显变化
②向X中加入过量浓硝酸,有红棕色气体生成
③分别用Ba(NO3)2溶液和BaCl2溶液检验实验②反应后的溶液,发现前者无变化,后者产生白色沉淀,其中,实验①的目的为___________,由上述实验现象可确定沉淀X的成分为___________(填化学式),实验②的化学方程式为___________。
-
常温下,往某浓度的氯水中滴人Na2S03溶液的pH变化如图所示,下列离子浓度的关系错误的是
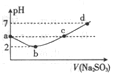
A. a点:c(H+)>c(Cl-)>c(ClO-)
B. b点:l/2 c(Cl-)=c(SO42-)=0.005mol·L-1
C. 点:c(Na+)=2c(HSO3-)+2c(SO32-)
D. d 点:c(Na+)=c(Cl-)+c(HSO3-)+2c(SO32-)+2c(SO42-)






