-
体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量
A. 相同 B. 中和HCl的多
C. 中和CH3COOH的多 D. 无法比较
难度: 中等查看答案及解析
-
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O
HCOO- + H3O+
B.CO2+H2O
HCO3- + H+ 1111
C.CO32- + H2O
HCO3- + OH-1
D.HS- + H2O
S2- + H3O+
难度: 中等查看答案及解析
-
室温下,0.1mol·L-1的硫酸中,水的KW值为
A.大于1×10-14 B.小于1×10-14
C.等于1×10-14 D.无法确定
难度: 简单查看答案及解析
-
下列溶液一定呈中性的是( )
A. pH=7的溶液
B. 使石蕊试液呈紫色的溶液
C. c(H+)=c(OH﹣)=10﹣6mol·L﹣1的溶液
D. 酸与碱恰好反应生成的溶液
难度: 中等查看答案及解析
-
一定温度下,向0.1 mol·L-1CH3COOH溶液中加少量水,下列有关说法错误的是( )
A. 溶液中所有离子的浓度都减小 B. CH3COOH的电离程度变大
C. 水的电离程度变大 D. 溶液的pH增大
难度: 中等查看答案及解析
-
在25.00ml碱式滴定管中盛有溶液,液面恰好在20.00ml刻度处,现将滴定管中全部溶液放出,流入量筒内,所得溶液体积为( )
A. 5mL B. 20mL C. 大于5mL D. 小于5mL
难度: 中等查看答案及解析
-
为了避免电解质溶液中CuSO4因水解发生沉淀,正确的操作方法是
A.加水稀释 B.加少量稀硫酸 C.加少量NaOH溶液 D.加热
难度: 简单查看答案及解析
-
在mA+nB====pC的反应中,m、n、p为各物质的化学计量数,现测得C每分钟增加a mol·L-1,B每分钟减少1.5a mol·L-1,A每分钟减少0.5a mol·L-1,则m∶n∶p为( )
A. 2∶3∶2 B. 2∶2∶3 C. 1∶3∶2 D. 3∶1∶2
难度: 中等查看答案及解析
-
能降低反应所需的活化能的是( )
A. 降低温度 B. 使用催化剂 C. 增大压强 D. 增加浓度
难度: 简单查看答案及解析
-
在2A+B===3C+4D反应中,表示该反应速率最快的数据是
A. v(A)=0.5 mol·L-1·s-1
B. v(B)=0.3 mol·L-1·s-1
C. v(C)=0.8 mol·L-1·s-1
D. v(D)=1.0 mol·L-1·s-1
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 100℃时,KW=10﹣12,此温度下pH=6的溶液一定显酸性
B. 25℃时,0.1mol/L的NaHSO3溶液pH=4,说明HSO3﹣在水溶液中只存在电离
C. NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用
D. 25℃时,10mL 0.1mol/L CH3COOH溶液与5mL 0.1mol/L NaOH溶液混合,所得溶液中有2c(Na+)═c(CH3COO﹣)+c(CH3COOH)
难度: 困难查看答案及解析
-
下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )
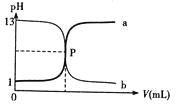
A. 盐酸的物质的量浓度为 1 mol/L
B. P 点时反应恰好完全中和,溶液呈中性
C. 曲线 a 是盐酸滴定氢氧化钠的滴定曲线
D. 酚酞不能用做本实验的指示剂
难度: 困难查看答案及解析
-
下列方法能使电离平衡H2O
H++OH﹣向右移动,且使液体呈酸性的是( )
A. 向水中加入少量硫酸铝固体
B. 向水中加入少量硫酸氢钠固体
C. 向水中加入少量碳酸钠固体
D. 将水加热到100℃,使水的pH=6
难度: 中等查看答案及解析
-
下列关于平衡常数K的说法中,正确的是
A. 在任何条件下,化学平衡常数是一个恒定值
B. 改变反应物浓度或生成物浓度都会改变平衡常数K
C. 平衡常数K只与温度有关,与反应浓度、压强无关
D. 从平衡常数K的大小不能推断一个反应进行的程度
难度: 中等查看答案及解析
-
下列实验能达到测量要求的是( )
A. 用托盘天平称取35.20g NaCl固体
B. 用25mL酸式滴定管量取15.80mL盐酸溶液
C. 用10mL量筒量取8.50mL盐酸
D. 用广泛pH试纸测得某溶液pH值为4.2
难度: 中等查看答案及解析
-
下列说法正确的是
A. 水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B. Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH4+)/c(NH3·H2O)的值增大
D. 室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
难度: 中等查看答案及解析
-
在某温度时,测定纯水中c(H+)=2.4×10-7 mol·L-1,则c(OH-)为( )
A. 2.4×10-7 mol·L-1
B. 0.1×10-7 mol·L-1
C.
mol·L-1
D. c(OH-)无法确定
难度: 中等查看答案及解析
-
在溶液中有浓度均为0.01mol·L﹣1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:25℃时,Ksp=4.0×10﹣38;Ksp=7.0×10﹣31,Ksp=1.0×10﹣17;Ksp=1.8×10﹣11.当其氢氧化物刚开始沉淀时,下列哪一种离子所需的pH最小( )
A. Fe3+ B. Cr3+
C. Zn2+ D. Mg2+
难度: 困难查看答案及解析
-
MOH强碱溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是
A. c(M+)>c(OH-)>c(A-)>c(H+) B. c(M+)>c(A-)>c(H+)>c(OH-)
C. c(M+)>c(A-)>c(OH-)>c(H+) D. c(M+)>c(H+)>c(A-)>c(OH-)
难度: 困难查看答案及解析
-
可逆反应2X(g)+Y(s)
2Z(g)在t1时刻达到平衡状态。当增大平衡体系压强(减小容器体积)时,下列有关正、逆反应速率(v)随时间变化的图象正确的是( )
A.
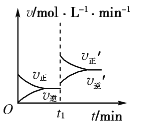 B.
B. 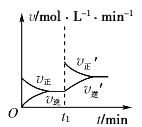 C.
C. 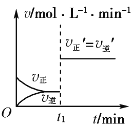 D.
D. 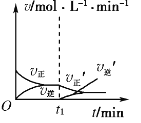
难度: 中等查看答案及解析