-
化学与社会、生活密切相关,下列说法正确的是
A. 氢氧化铝、碳酸钠常用作胃酸中和剂
B. 蚕丝和人造丝充分水解后均可得到氨基酸
C. 食盐可作调味剂,也可作食品防腐剂
D. 用浓硫酸刻蚀石英材料制作艺术品
难度: 简单查看答案及解析
-
李时珍在《本草纲目》中写到:“烧酒非古法也,白元时始创其法。用浓酒和糟入甑,蒸令气上,用器承取滴露。”文中涉及的操作方法是
A. 蒸馏 B. 升华 C. 萃取 D. 干馏
难度: 简单查看答案及解析
-
已知反应X(g)+3Y(g)
2Z(g) △H的能量变化如下图所示。下列说法正确的是
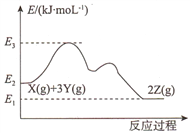
A. △H= E2- E1 B. 更换高效催化剂,E3不变
C. 恒压下充入一定量的氦气n(Z)减少 D. 压缩容器,c(X)减小
难度: 困难查看答案及解析
-
下列事实能证明HCOOH为弱酸的是
A. 可与Na2CO3反应生成CO2
B. 常温时HCOONa溶液的pH大于7
C. 导电能力低于同浓度的硫酸
D. 0.1mol/LHCOOH溶液可以使甲基橙变红
难度: 简单查看答案及解析
-
下列关于有机化合物说法正确的是
A. 有机物
的名称是2,3,5,5-四甲基-4-乙基己烷
B. 乙酸乙酯在碱性条件下的水解反应称为皂化反应
C. 有机物
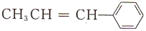 中可能共面的原于数最多有17个
中可能共面的原于数最多有17个D. 乙醛和丙烯醛(
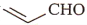 )不是同系物,分别与足量H2反应后的产物也不是同系物
)不是同系物,分别与足量H2反应后的产物也不是同系物难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 30g乙烷中所含的极性共价键数目为7NA
B. 1molSO2与足量02反应生成SO3分子数目为NA
C. 标准状况下22.4LCHCl3中含有的Cl原子数目为3NA
D. 1.0LO.1mol/L的NaClO溶液中含有的ClO-数目小于0.1NA
难度: 简单查看答案及解析
-
分子式为C10Hl2O2,能与NaHCO3溶液反应放出CO2,且米环上一氯代物有两种的有机物有(不考虑立体异构)
A. 7种 B. 9种 C. 11种 D. 12种
难度: 困难查看答案及解析
-
五种常见物质的转化关系如图所示(部分反应物及产物略去),其中Q、M、N含有某种相同的元素。下列说法不正确的是
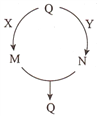
A. 若Q为N2,则X可能为氢气 B. 若Q为A1(OH)3,则Y可能为稀硫酸
C. 若Q为Fe,则Y可能为稀硝酸 D. 若Q为NaHCO3,则X可能为氢氧化钠溶液
难度: 困难查看答案及解析
-
向偏铝酸钠溶液中逐滴加入盐酸,溶被的pH值随着加入盐酸体积的变化曲线如图所示,则下列说法正确的是
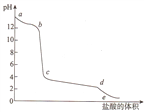
A. a~b段的主要离子方程式为A102-+4H+=Al3++2H2O
B. 向c点溶液中滴加氨水,发生的离子方程式为A13++30H-=Al(OH)3↓
C. c~d段的主要离子方程式为Al(OH)3+3H+= A13++3H2O
D. 向c点溶液中加入碳酸钠,发生的离子方程式为2 A13++CO32-+3H2O =2Al(OH)3↓+CO2↑
难度: 困难查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
操作
现象
结论或解释
A
向两份4mL0.2mol/L酸性KMnO4溶液中分别滴加2mL0.01mol/L和0.02mol/L草酸溶液
滴加0.02mol/L草酸溶液的先褪色
反应物浓度越大,反应速率越快
B
向Na2SiO3溶液中液加稀盐酸
产生白色沉淀
非金属性:Cl>Si
C
将Fe(NO3)2晶体溶于稀硫酸,滴加KSCN溶液
溶液变红
Fe(NO3)2晶体已变质
D
滴有酚酞的Na2CO3溶液中加入BaCl2固体
溶液红色变浅
Na2CO3溶液中存在水解平衡
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
前20号主族元素W、X、Y、Z的原子序数依次增大。W的原子最外层电子数是次外层电子数的3倍。X、Y、Z分属不同的周期,它们的原子序数之和是W原子序数的5倍。含有元素Z的盐的焰色反应为紫色。下列说法正确的是
A. 原子半径的大小W
B. 简单氢化物的热稳定性W>X
C. X、Y的简单离子具有相同的电子层结构
D. 工业上通过电解W、Y组成的化合物制备单质Y
难度: 简单查看答案及解析
-
某科研小组利用如下反应消除NO和CO的污染;2NO(g)+2CO(g)
N2(g)+2CO2(g) △H=xkJ/mol。T℃时,在容积为2L的恒容密闭容器中充入2molNO和2molCO,保持温度不变,5min时达到平衡状态,此时c(N2)=0.4mol/L。下列说法中不正确的是 ( )
A. x<0
B. α(NO)=80%
C. 0~5min内,V(CO)=0.16mol/(L·min)
D. 保持温度不变,若再向上述平衡体系中充入2molNO和2molCO,重新达平衡时,c(N2)=0.8mol/L
难度: 困难查看答案及解析
-
已知p(A)=-lgc(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
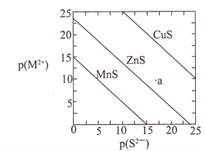
A. a点无ZnS沉淀生成
B. 可用MnS除去MnCl2溶液中混有的少量ZnCl2
C. 向CuS悬浊液中加入少量水,平衡向溶解的方向移动,c(S2-)增大
D. CuS和MnS共存的悬独液中,
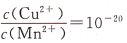
难度: 困难查看答案及解析
-
以铅蓄电池为电源.通过电解法制备酒石酸(C4H606,简写为RH2)的原理如图所示(A、B为惰性电极,a、b为离子交换膜)
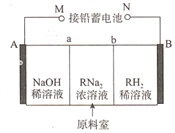
下列叙述不正确的是
A. N极的电极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O
B. b为阴离子交换膜
C. 阴极反应为2H20+2e-=H2↑+20H-,阴极区溶液pH升高
D. 铅蓄电池中消耗2molH2SO4时,理论上生成2molRH2
难度: 中等查看答案及解析
-
为验证还原性:SO2>Fe2+>C1-,三组同学分别进行了下图实验,并对溶液1和溶液2中所含离子进行了检验,能证明上述还原性顺序的实验组有
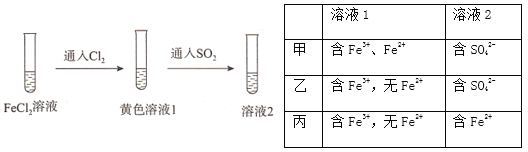
A. 只有甲 B. 甲、乙 C. 甲、丙 D. 甲、乙、丙
难度: 中等查看答案及解析
-
常温下,将HC1气体通入到1L浓度均为0.1mol/L的NaA和NaB的混合溶液中,混合溶液的pH与离子浓度变化的关系如图所示(忽略溶液体积的变化)。下列叙述不正确的是
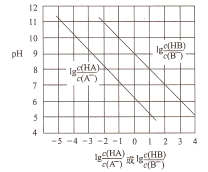
A. Ka(HB)的数量级为10-9
B. 酸性的强弱顺序为HCl>HA>HB
C. 当通入0.1molHC1气体时,c(B-)>c(A-)
D. 当混合溶液呈中性时,c(Na+)=c(Cl-)+c(A-)+c(B-)
难度: 困难查看答案及解析
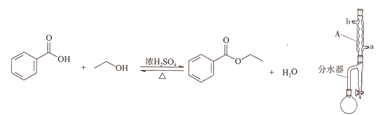
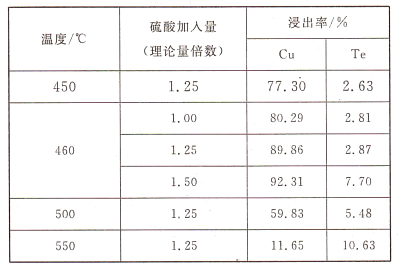
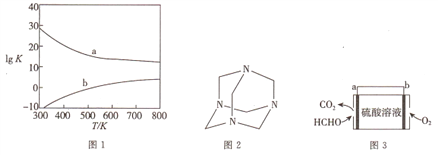
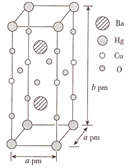
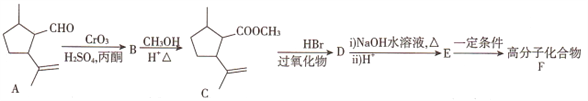
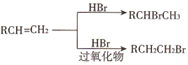
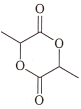 的合成路线______。(其他试剂任选)
的合成路线______。(其他试剂任选)