-
下列属于非电解质的是:
A. Cl2 B. 医用酒精 C. CO2 D. CH3COOH
难度: 简单查看答案及解析
-
下列属于吸热反应的是:
A. 实验室用锌粒与稀硫酸反应制备氢气 B. 工业上冶炼铁时还原剂产生过程
C. 反应物的总键能低于生成物的总键能 D. 乙醇在红热的铜丝作用下氧化生成乙醛
难度: 简单查看答案及解析
-
下列说法不正确的是:
A. 科里创立了有机化合物合成的“逆合成分析理论”
B. 中国是第一个人工合成蛋白质(结晶牛胰岛素)的国家
C. 维勒是第一个由无机物[CO(NH2)2]合成有机物(NH4CNO)的化学家
D. 海维西运用“同位素示踪法”,在研究化学反应方面作出了重要贡献
难度: 中等查看答案及解析
-
下列方法与有机物的结构研究无关的是:
A. 分光光度法 B. 核磁共振法 C. 紫外光谱法 D. 红外光谱法
难度: 中等查看答案及解析
-
如图所示:a为铁片、b为铜片。下列叙述不正确的是:
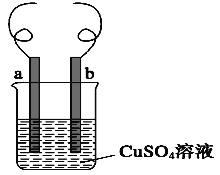
A. a和b是否用导线连接时,都会有金属铜析出
B. a和b用导线连接比a和b不连接的反应速率要快
C. a和b用导线连接时,铜片上反应:Cu2++2e-=Cu
D. 无论a和b用导线是否连接,铁片上产生的现象相同
难度: 中等查看答案及解析
-
在一定条件下,反应:X(g)+2Y(g)
2Z(g) △H=-a kJ·mol-1,达到化学平衡时,则下列说法中不正确的是:
A. 该反应可能放出a kJ热量 B. 各物质浓度c(X) : c(Y) : c(Z)肯定不变
C. X与Y的物质的量肯定之比为1 : 2 D. 容器中肯定同时存在X、Y、Z三种物质
难度: 中等查看答案及解析
-
下列各项事实中,其中能说明HA是弱酸的是:
① 0.1 mol·L-1 HA溶液能使石蕊试液变红色;
② 0.1 mol·L-1 NaA溶液能使酚酞试液变红色;
③ 0.1 mol·L-1 HA溶液导电性比1.0 mol·L-1 盐酸弱;
④ HA滴入NaHCO3溶液中产生气泡;
⑤ 等体积的0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液恰好完全反应。
A. ② B. ②③ C. ②③④ D. ①②③④⑤
难度: 困难查看答案及解析
-
下列变化过程不能用勒夏特列原理解释的是:
A. 热的纯碱溶液洗涤油渍效果较好 B. 将AlCl3溶液蒸干、灼烧,得到Al2O3固体
C. 实验室配制FeCl3溶液时滴入盐酸 D. 制硫酸工业中,采用500℃左右氧化SO2
难度: 中等查看答案及解析
-
下列说法不正确的是:
A. 能发生化学反应的分子,肯定是活化分子
B. 已知x(500℃)和y(25℃) 两个反应,则反应速率:v(x)>v(y)
C. 反应:CaCO3(s)=CaO(s)+CO2(g)能否自发进行,主要由△S>0决定
D. 升高温度或加入催化剂都能使单位体积内活化分子的百分数增大,但原因不同
难度: 困难查看答案及解析
-
在恒温恒容中反应:2NO2(g)
2NO(g)+O2(g),能说明反应达平衡状态的是:
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时生成2n mol NO;
③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态;
④混合气体的颜色不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
A. ①④⑥ B. ②③⑤ C. ①③④ D. 全部
难度: 中等查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图。下列说法不正确的是:
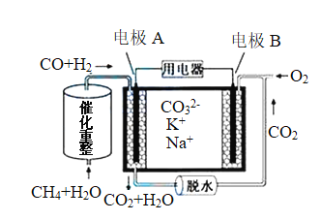
A. 电池工作时,CO32-向电极A移动
B. 电极A上H2参与的电极反应:H2-2e-=2H+
C. 电极B上发生电极反应:O2+2CO2+4e-=2CO32-
D. 反应CH4+H2O=3H2+CO,每消耗22.4 L CH4气体,转移6 mol e-
难度: 困难查看答案及解析
-
某研究小组研究不同催化剂对2 L相同浓度H2O2溶液分解反应的催化效果时所得实验结果(O2体积均换算为标准状况下,忽略反应前后体积变化)如表,下列说不正确的是:
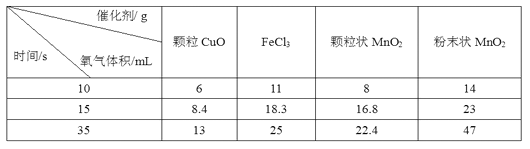
A. 在15~35 s内,FeCl3的催化作用比颗粒状MnO2好
B. 固体催化剂的颗粒大小对反应的催化作用没有影响
C. 催化效率由大到小的顺序:粉末状MnO2 、FeCl3、颗粒CuO
D. 在颗粒状MnO2催化作用下,0~15 s内v(H2O2)=5.0×10-5 mol·L-1 ·s-1
难度: 困难查看答案及解析
-
用惰性电极电解足量的下列各溶液,电解一段时间后,加入括号内适量的物质,不可能使电解后溶液恢复到电解前的状态的是:
A. KCl(HCl气体) B. CuSO4(CuCO3固体)
C. Na2SO4(H2O) D. CuCl2(CuO固体)
难度: 困难查看答案及解析
-
氢卤酸能量关系如图。下列说法不正确的是:
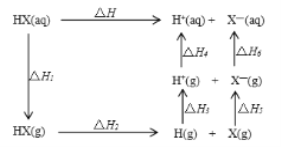
A. 相同条件下,HCl的△H2比HBr的小
B. 已知HF气体溶于水放热,则HF的△H1>0
C. 相同条件下,HCl的△H3+△H4与HI的一样大
D. 一定条件下气态原子生成1 mol H-X键放出a kJ能量,则该条件下△H2=a kJ • mol-1
难度: 中等查看答案及解析
-
已知:H2的标准燃烧热为-286 kJ · mol-1,CO的标准燃烧热为-283 kJ · mol-1,液态甲醇(CH3OH)标准燃烧热为-726 kJ · mol-1。由H2(g)与CO2(g)合成CH3OH(l)的ΔH为:
A. +297 kJ · mol-1 B. +151 kJ · mol-1
C. -132 kJ · mol-1 D. -1548 kJ · mol-1
难度: 中等查看答案及解析
-
下列各组混合物,可由分液漏斗直接分离的是:
A. 苯和四氯化碳 B. 甲苯和水 C. 酒精和水 D. 溴和酒精
难度: 简单查看答案及解析
-
下列各组混合物,可用水鉴别的是:
A. 苯和乙苯 B. 甲苯和四氯化碳 C. 硝基苯和四氯化碳 D. 酒精和乙醛
难度: 简单查看答案及解析
-
CH2=C(CH3)CH=CH2与一定量的HBr在一定条件下加成,生成的产物有:
A. 4种 B. 5种 C. 8种 D. 10种
难度: 中等查看答案及解析
-
下列物质的一溴取代物只有3种的是:
A.
B.
C.
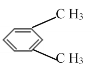 D.
D. 难度: 中等查看答案及解析
-
下列各分子中,所有C原子肯定在同一平面的是:
A. CH3CH=CHCH2CH3 B. CH3CH=CHCH2C≡CH
C.
D.

难度: 中等查看答案及解析
-
一定条件下,0.05 mol烃刚好与0.1 mol HCl完全加成,生成的有机物在光照下刚好与0.4 mol Cl2完全取代。则该烃可能是:
A. CH2=CHCH2CH3 B. CH2=CHCH3
C. CH3C≡CCH2CH3 D. CH2=CHCH=CH2
难度: 困难查看答案及解析
-
下列各种说法中,其中正确的是:
A. NaCl溶液和NaClO溶液中都含有5种微粒
B. 0.1mol · Lˉ1的氨水能使酚酞试液变红,说明一水合氨是弱电解质
C. 常温下,pH相等的NaOH溶液和CH3COONa溶液中,由水电离的OH−浓度不相等
D. 常温下,浓度相等的盐酸和醋酸溶液,加水稀释相同倍数后,盐酸的pH大于醋酸
难度: 困难查看答案及解析
-
如图装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中正确的是:
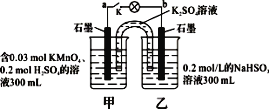
A. 当电路中有0.06 mol电子转移时,乙烧杯中溶液c(H+) 约为0.1 mol · L-1
B. 乙池中的还原产物为SO42-
C. 电池工作时,甲烧杯中溶液的pH逐渐增大
D. 电池工作时,盐桥中的K+移向乙烧杯,外电路的电流方向是从b到a
难度: 中等查看答案及解析
-
如图所示是两种气态烃组成的混合气体完全燃烧所得的CO2和H2O的物质的量(单位:mol)的变化关系。下列判断不正确的是:
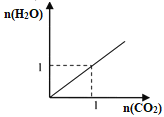
A. 一定含有甲烷
B. 可能含有乙烷
C. 可能含有乙炔
D. 若120℃不变,反应前后气体体积不一定发生变化
难度: 困难查看答案及解析
-
常温下10 mL某气态烃与40 mL氧气混合,烃完全燃烧后恢复到反应前的状况,测得气体的体积为25 mL。则下列烃符合上述情况的是:
A. C2H2 B. C2H6 C. C3H6 D. C3H8
难度: 中等查看答案及解析
-
常温下,向10 mL 0.1 mol·L-1的一元酸HA溶液中加入0.1 mol · L-1 NaOH溶液,HA和A- 的物质的量分数(α)随溶液pH变化的关系如图所示,下列说法正确的是:

A. pH<5.5时,c(HA)<c(A-)
B. pH>8时,c(Na+)+c(H+)>c(A-)
C. pH=7时,c(HA)>c(A-)>c(OH-)=c(H+)
D. pH=5时α(HA)与α(Aˉ)之和比pH=9时α(HA)与α(Aˉ)之和大
难度: 困难查看答案及解析



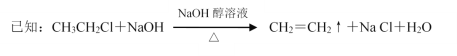
 __________
__________