-
(1)SO2、NOx、CO等气体和可吸入颗粒物对环境的污染尤其严重,为了减少它们对环境的污染,通常采用下列措施进行处理:
已知:①N2(g)+O2(g) 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
可以在汽车的排气管上安装一个催化装置,使汽车尾气中的CO、NO转化成无污染的物质,则该反应热化学方程式为____________________________,该反应自发进行的条件是_________。
(2)通常将SO2经过净化后,与空气进行催化氧化可制硫酸。不同温度下向一恒容密闭容器中通入n(SO2) : n(O2)=2 : 1[2SO2(g)+O2(g) 2SO3(g)],测得容器内总压强与反应时间如图1所示。
2SO3(g)],测得容器内总压强与反应时间如图1所示。

①下列说法不正确的是________;
A.T2>T1 B.该反应正向是吸热反应 C.增大压强一定以使平衡正向移动
D.其他条件不变,向平衡体系中再按物质的量之比为2 : 1充入SO2和O2,达到新的平衡后SO2平衡转化率增大
②图中B点的平衡常数Kp=__________________________(提示:用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数)
③ 在压强为p1 MPa下,将2.0 mol SO2(g)和1.0 mol O2(g)充入容积为2 L的密闭容器中,反应达到平衡时,测得SO3气体的体积分数随温度的变化曲线如图所示,请在图中画出p2 MPa(p1<p2 )时平衡体系中SO3气体的体积分数随温度变化的曲线(表明p2 )。 ______________

(3)NH4Cl溶液呈酸性的原因(用相应离子方程式表示)______________________________;常温下,若用pH=3的盐酸滴定pH=11的氨水生成NH4Cl溶液,则用去两溶液的体积关系:V(盐酸)________V(氨水)(填“>”、“=”或“<”),滴定终点的判断:__________________。
-
(1)工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)=H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为______________
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、 1molCO2生成的同时有3molH-H键断裂
1molCO2生成的同时有3molH-H键断裂
(2)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是___________________
2)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0 kJ·mol一1上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_________mol。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2(g) CH4(g)+2H2O(g),向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2
CH4(g)+2H2O(g),向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2 O1.6 mol·L一1。则CO2的平衡转化率为____________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_________(填“>’’或“<”)O。
O1.6 mol·L一1。则CO2的平衡转化率为____________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_________(填“>’’或“<”)O。
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9KJ·g-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为 。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)  CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
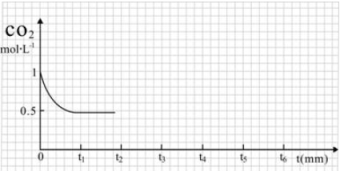
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。
(2)改变温度,使反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 反应I 恒温恒容 | 0 min | 2 | 6[ | 0 | 0 |
| 10min | | 4.5 | | |
| 20min | 1 | | | |
| 30min | | | 1 | |
| 反应II 绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K(I) K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II)。
②对反应I,前10min内的平均反应速率v(CH3OH)= ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。
若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol N2(g) +2O2(g) = 2NO2(g)△H = +133kJ/mol、H2O(g) = H2O(l) △H = -44kJ/mol。催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为_____________________。
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g) + 3H2(g)  CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
(1)①该反应自发进行的条件是__________(填“低温”、“高温”或“任意温度”),
②下列叙述能说明此反应达到平衡状态的是___________。
a.混合气体的平均式量保持不变 ;b.CO2和H2的体积分数保持不变;
c. CO2和H2的转化率相等 ;d.混合气体的密度保持不变
e.1molCO2生成的同时有3molH—H键断裂
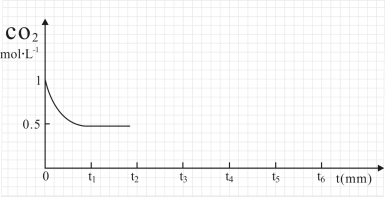
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6内CO2的浓度随时间的变化_____。
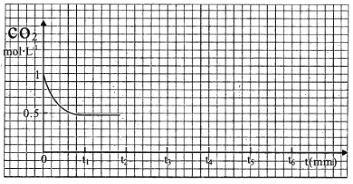
(2)改变温度,使反应CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
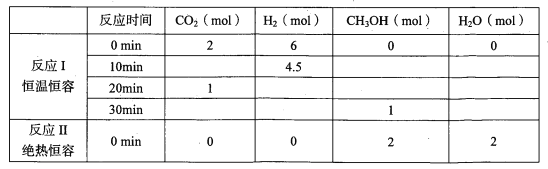
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)_______K(II)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(I)_______c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______________。在其它条件不变下,若30min时只改变温度为T2 ℃,此时H2的物质的量为3.2mol,则T1______T2(填“>”、“<”或“=”)。若30min时向容器中再充入1molCO2和1molH2O(g),则平衡_________移动(填“正向”、“逆向”或“不”)。
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9KJ·g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ·mol-1
H2O(g)=H2O(l)△H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为。
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)  CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
③ CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。
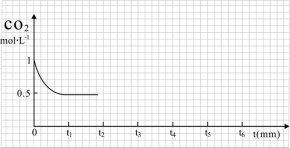
(2)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
| 10min | | 4.5 | | |
| 20min | 1 | | | |
| 30min | | | 1 | |
| 反应II 绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
① 达到平衡时,反应I、II对比:平衡常数K(I) K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II)。
② 对反应I,前10min内的平均反应速率v(CH3OH)= ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
-
(12分)工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ、脱硝:已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)=H2O(l) △H=-44 kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为 。
Ⅱ、脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1mol CO2生成的同时有3mol H—H键断裂
③ CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。
(2)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度和体积均相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度和体积均相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 反应I | 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | | 4.5 | | |
| 20min | 1 | | | |
| 30min | | | 1 | |
| 反应II | 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
| | | | | | |
达到平衡时,反应I、II对比:平衡常数K(I) K(II)(填“>”“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II)。
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
H2O(g)=H2O(l)△H=-44kJ/mol
(1)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为__________________________。
Ⅱ.脱碳:
(2)向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) CH3OH(l)+H2O(l)。
CH3OH(l)+H2O(l)。
下列叙述能说明此反应达到平衡状态的是__________。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变;
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1molCO2生成的同时有3molH—H键断裂
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g)+2H2(g) CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。
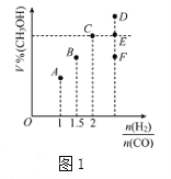
①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率V(H2)=__________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图1中的___________点(选填“D”、“E”或“F”)
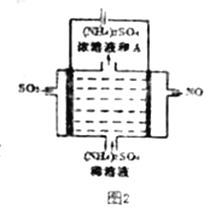
Ⅲ.脱硫:
如图2所示。
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8 kJ·mol-1
N2(g)+2O2(g) =2NO2(g) ΔH = +133 kJ·mol-1
H2O(g) = H2O(l) ΔH =-44 kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:__________________________。
Ⅱ.脱碳:
(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”)。
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均摩尔质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H—H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2浓度随时间的变化。________________________
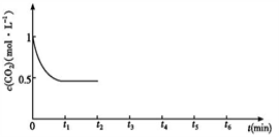
(2)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | | 4.5 | | |
| 20min | 1 | | | |
| 30min | | | 1 | |
| 反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)______ K(II)(填“﹥”、“﹤”或“=”下同);平衡时CH3OH的浓度c(I)____ c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH) =______________ 。在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1___T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡_____移动(填“正向”、“逆向”或“不”)。
(3)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
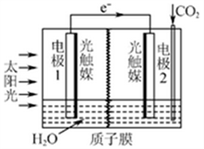
①电极2的电极反应式是____________;
②在标准状况下,当电极2室有11.2L CO2反应。 理论上电极1室液体质量_____(填“增加”或“减少”)______g。
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱碳:
向2L密闭容器中加入2mol CO2、8mol H2,在适当的催化剂作用下,发生反应:CO2(g)+4H2(g)  CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
(1)该反应自发进行的条件是_______(填“低温”、“高温”或“任意温度”)
(2)下列叙述能说明此反应达到平衡状态的是_______________。
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数比为1﹕4
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有4mol H-H键断裂
Ⅱ.脱硝:
(3)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的化学方程式为__________。
(4)温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)  2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是__________。
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是__________。
| 容器 编号 | 物质的起始浓度 (mol·L-1) | 物质的平衡浓度 (mol·L-1) |
| c(NO2) | c(NO) | c(O2) | c(O2) |
| 甲 | 0.6 | 0 | 0 | 0.2 |
| 乙 | 0.3 | 0.5 | 0.2 | |
| 丙 | 0 | 0.5 | 0.35 | |
A.容器甲中发生反应的平衡常数为0.8
B.容器乙中起始时反应正向进行
C.达到平衡时,容器丙中c(O2)/c(NO2)>1
D.达到平衡时,容器甲与容器丙中的总压强之比为16∶17
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行处理可实现绿色环保、废物利用。
Ⅰ.CO可用于合成甲醇
(1)已知CO、H2、CH3OH(g)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-764.5kJ/mol,则CO(g)+2H2(g) CH3OH(g)的△H=________。
CH3OH(g)的△H=________。
(2)将lmolCO和2molH2充入密闭容器中发生上述反应。其他条件相同时.CO的平衡转化率与压强(P)和温度(T)的关系如图所示。
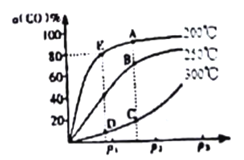
① A、B两点CH3OH的质量分数ω(A)_____ω(B )(填“>”、“<”或“=”)。
② C、D两点的逆反应速率:v(C)_____v(D)(同上)。
③ 200℃ 时,测得E点的容器容积为10L。该温度下,反应的平街常数K=_______;保持温度和容积不变,再向容器中充入lmolCO、lmolH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为________。
Ⅱ. CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景。T℃时,在容积为lL的恒容密闭容器中,充入lmolCO2和3molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0,达到平衡状态,其它条件不变,下列措施中能使
CH3OH(g)+H2O(g) △H<0,达到平衡状态,其它条件不变,下列措施中能使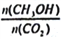 增大的是______(填选项字母)。
增大的是______(填选项字母)。
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g)
C.加入催化剂 D.再充入一定量H2O
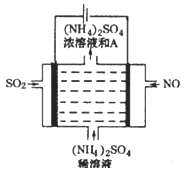
Ⅲ.(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_____,阴极的电极反应式是_____________。
2NO(g) ΔH1=+180 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
2SO3(g)],测得容器内总压强与反应时间如图1所示。












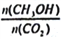 增大的是______(填选项字母)。
增大的是______(填选项字母)。