-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱碳:
向2L密闭容器中加入2mol CO2、8mol H2,在适当的催化剂作用下,发生反应:CO2(g)+4H2(g)  CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
(1)该反应自发进行的条件是_______(填“低温”、“高温”或“任意温度”)
(2)下列叙述能说明此反应达到平衡状态的是_______________。
a、混合气体的平均相对分子质量保持不变
b、CO2和H2的体积分数比为1﹕4
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有4mol H-H键断裂
Ⅱ.脱硝:
(3)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的化学方程式为__________。
(4)温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)  2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是__________。
2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是__________。
| 容器 编号 | 物质的起始浓度 (mol·L-1) | 物质的平衡浓度 (mol·L-1) |
| c(NO2) | c(NO) | c(O2) | c(O2) |
| 甲 | 0.6 | 0 | 0 | 0.2 |
| 乙 | 0.3 | 0.5 | 0.2 | |
| 丙 | 0 | 0.5 | 0.35 | |
A.容器甲中发生反应的平衡常数为0.8
B.容器乙中起始时反应正向进行
C.达到平衡时,容器丙中c(O2)/c(NO2)>1
D.达到平衡时,容器甲与容器丙中的总压强之比为16∶17
-
(1)工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)=H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为______________
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、 1molCO2生成的同时有3molH-H键断裂
1molCO2生成的同时有3molH-H键断裂
(2)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是___________________
2)资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0 kJ·mol一1上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_________mol。
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2(g) CH4(g)+2H2O(g),向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2
CH4(g)+2H2O(g),向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2 mol·L一1,H2 0.8 mol·L一1,CH40.8 mol·L一1,H2 O1.6 mol·L一1。则CO2的平衡转化率为____________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_________(填“>’’或“<”)O。
O1.6 mol·L一1。则CO2的平衡转化率为____________。300 ℃时上述反应的平衡常数K=____________________。200℃时该反应的平衡常数K=64.8,则该反应的△H_________(填“>’’或“<”)O。
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol N2(g) +2O2(g) = 2NO2(g)△H = +133kJ/mol、H2O(g) = H2O(l) △H = -44kJ/mol。催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为_____________________。
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g) + 3H2(g)  CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
(1)①该反应自发进行的条件是__________(填“低温”、“高温”或“任意温度”),
②下列叙述能说明此反应达到平衡状态的是___________。
a.混合气体的平均式量保持不变 ;b.CO2和H2的体积分数保持不变;
c. CO2和H2的转化率相等 ;d.混合气体的密度保持不变
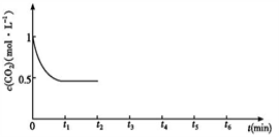
e.1molCO2生成的同时有3molH—H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6内CO2的浓度随时间的变化_____。
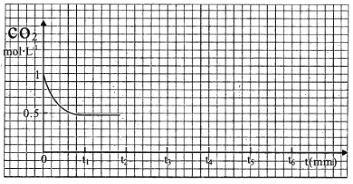
(2)改变温度,使反应CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)_______K(II)(填“>”、“<”或“=”,下同);平衡时CH3OH的浓度c(I)_______c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______________。在其它条件不变下,若30min时只改变温度为T2 ℃,此时H2的物质的量为3.2mol,则T1______T2(填“>”、“<”或“=”)。若30min时向容器中再充入1molCO2和1molH2O(g),则平衡_________移动(填“正向”、“逆向”或“不”)。
-
(12分)工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ、脱硝:已知:H2的燃烧热为285.8kJ·mol-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)=H2O(l) △H=-44 kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为 。
Ⅱ、脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1mol CO2生成的同时有3mol H—H键断裂
③ CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。
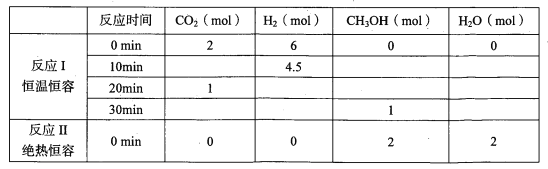
(2)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度和体积均相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度和体积均相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 反应I | 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | | 4.5 | | |
| 20min | 1 | | | |
| 30min | | | 1 | |
| 反应II | 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
| | | | | | |
达到平衡时,反应I、II对比:平衡常数K(I) K(II)(填“>”“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II)。
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+133kJ/mol
H2O(g)=H2O(l)△H=-44kJ/mol
(1)催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为__________________________。
Ⅱ.脱碳:
(2)向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) CH3OH(l)+H2O(l)。
CH3OH(l)+H2O(l)。
下列叙述能说明此反应达到平衡状态的是__________。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变;
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1molCO2生成的同时有3molH—H键断裂
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g)+2H2(g) CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图1所示。
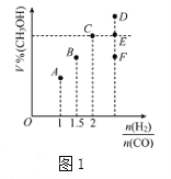
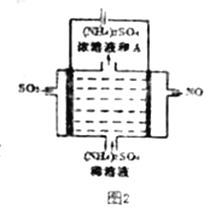
①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率V(H2)=__________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图1中的___________点(选填“D”、“E”或“F”)
Ⅲ.脱硫:
如图2所示。
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为285.8 kJ·mol-1
N2(g)+2O2(g) =2NO2(g) ΔH = +133 kJ·mol-1
H2O(g) = H2O(l) ΔH =-44 kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:__________________________。
Ⅱ.脱碳:
(1)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
①该反应自发进行的条件是_____________(填“低温”、“高温”或“任意温度”)。
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均摩尔质量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H—H键断裂
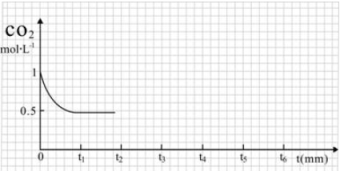
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2浓度随时间的变化。________________________
(2)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) ΔH﹤0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | | 4.5 | | |
| 20min | 1 | | | |
| 30min | | | 1 | |
| 反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)______ K(II)(填“﹥”、“﹤”或“=”下同);平衡时CH3OH的浓度c(I)____ c(II)。
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH) =______________ 。在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1___T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡_____移动(填“正向”、“逆向”或“不”)。
(3)利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O=2HCOOH+O2,装置如图所示:
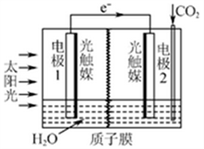
①电极2的电极反应式是____________;
②在标准状况下,当电极2室有11.2L CO2反应。 理论上电极1室液体质量_____(填“增加”或“减少”)______g。
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9KJ·g-1
N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为 。
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)  CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
③CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。
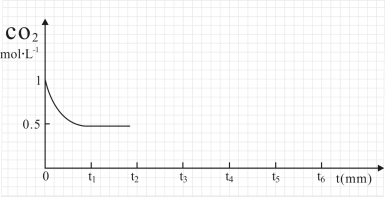
(2)改变温度,使反应CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 反应I 恒温恒容 | 0 min | 2 | 6[ | 0 | 0 |
| 10min | | 4.5 | | |
| 20min | 1 | | | |
| 30min | | | 1 | |
| 反应II 绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K(I) K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II)。
②对反应I,前10min内的平均反应速率v(CH3OH)= ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。
若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的热值为142.9KJ·g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ·mol-1
H2O(g)=H2O(l)△H=-44kJ·mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为。
Ⅱ.脱碳:向2L密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)  CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 。
a、混合气体的平均式量保持不变
b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等
d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
③ CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。
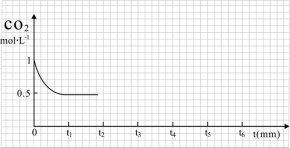
(2)改变温度,使反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
CH3OH(g)+H2O(g) △H<0 中的所有物质都为气态。起始温度体积相同(T1℃、2 L密闭容器)。反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 反应I 恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
| 10min | | 4.5 | | |
| 20min | 1 | | | |
| 30min | | | 1 | |
| 反应II 绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
① 达到平衡时,反应I、II对比:平衡常数K(I) K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II)。
② 对反应I,前10min内的平均反应速率v(CH3OH)= ,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
-
工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用。
Ⅰ、脱硝:
已知:
①H2的燃烧热ΔH=-285.8kJ/mol
②N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为: ________。
Ⅱ、脱碳
工业上可用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 500℃ | 800℃ |
| ①2H2(g)+CO(g)  CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)  H2O(g)+CO(g) H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)  CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | K3 | | |
(1)某温度下在容积为2L的密闭容器中进行反应①,其相关数据如图;反应开始至平衡
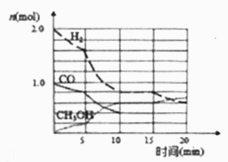
①用H2表示化学反应速率为________。
②5min时改变的反应条件可能是____________。
A. 缩小容器体积
B. 使用催化剂
C. 降低温度
D.充入氮气
(2)若向2L密闭容器中加入1molCO2、3molH2,发生上述反应③。
①下列情况能说明反应已达平衡状态的是________(填字母)。
A.容器内气体密度不变 B.容器内气体总压强保持不变
C.绝热恒容时,平衡常数不变 D.v正(CH3OH)=3v逆(H2)
②据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示),该反应的△H_____0(填“>”或“=”或“<”)。
③500℃时测得反应③在某时刻起始加入0.5molCO2、1molH2、0.5molCH3OH(g)、1molH2O(g) 则此反应速率的关系:v正__________v逆。(填“>”、 “=” 或“<”)
④相同条件下,在容积都为2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡。
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3molH2 | amol CO2、3amolH2 bmolCH3OH(g)、bmolH2O(g) |
若甲中平衡后气体的压强为开始的0.6倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆向反应方向进行,则b的取值范围为_________(a、b均不为0)。
-
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行处理可实现绿色环保、废物利用。
Ⅰ.CO可用于合成甲醇
(1)已知CO、H2、CH3OH(g)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-764.5kJ/mol,则CO(g)+2H2(g) CH3OH(g)的△H=________。
CH3OH(g)的△H=________。
(2)将lmolCO和2molH2充入密闭容器中发生上述反应。其他条件相同时.CO的平衡转化率与压强(P)和温度(T)的关系如图所示。
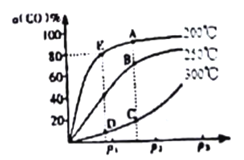
① A、B两点CH3OH的质量分数ω(A)_____ω(B )(填“>”、“<”或“=”)。
② C、D两点的逆反应速率:v(C)_____v(D)(同上)。
③ 200℃ 时,测得E点的容器容积为10L。该温度下,反应的平街常数K=_______;保持温度和容积不变,再向容器中充入lmolCO、lmolH2和xmolCH3OH时,若使v正>v逆,则x的取值范围为________。
Ⅱ. CO2的综合利用
(3)CO2转化为甲醇有广泛应用前景。T℃时,在容积为lL的恒容密闭容器中,充入lmolCO2和3molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0,达到平衡状态,其它条件不变,下列措施中能使
CH3OH(g)+H2O(g) △H<0,达到平衡状态,其它条件不变,下列措施中能使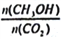 增大的是______(填选项字母)。
增大的是______(填选项字母)。
A.升高温度 B.再充入1molCH3OH(g)和1molH2O(g)
C.加入催化剂 D.再充入一定量H2O
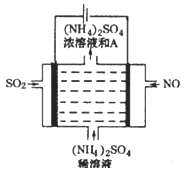
Ⅲ.(4)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_____,阴极的电极反应式是_____________。
CH3OH(l) + H2O(l) △H < 0

CH3OH(g) + H2O(g) △H < 0中的所有物质都为气态。起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:










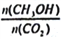 增大的是______(填选项字母)。
增大的是______(填选项字母)。