-
下列不利于“清水蓝天”工程实施的是
A.加大稀土资源的开采和出口,保证经济快速发展
B.加强城市生活污水脱氮除磷处理,遏制水体富营养化
C.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用
D.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
难度: 简单查看答案及解析
-
下列有关化学用语正确的是( )
A.甲烷分子的球棍模型:
B.NH4I的电子式:
C.F的原子结构示意图:
D.中子数为20的氯原子:
Cl
难度: 简单查看答案及解析
-
生活中常用到一些化学知识,下列分析中正确的是
A.医疗上可用硫酸钡作x射线透视肠胃的内服药,是因硫酸钡不溶于水
B.某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中溶解的CO2增多
C.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性
D.加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水
难度: 简单查看答案及解析
-
下列各组离子,在指定的环境中一定能大量共存的是( )
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、SCN-
B.含有大量HCO3-的溶液:NH4+、Ca2+、Mg2+、I-
C.在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3-
D.含有大量ClO-的溶液:H+、Mg2+、I-、SO42-
难度: 简单查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A是组成有机物的必要元素,元素B的原子最外层电子数是其电子层数的3倍,元素D与A为同族元素,元素C与E形成的化合物CE是厨房常用调味品。下列说法正确的是
A.原子半径:C>D>A>B
B.C和E的单质可通过电解饱和的CE水溶液获得
C.C与B形成的两种化合物中化学键类型完全相同
D.A、D、E的最高价氧化物对应水化物的酸性逐渐增强
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO—+Fe(OH)3= FeO42—+3Cl—+H2O+4H+
B.用Na2O2与H2O反应制备O2:Na2O2+ H2O=2Na++2OH-+ O2↑
C.向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++NO-3+4H+-=3Fe3++NO↑+2H2O
D.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:
难度: 简单查看答案及解析
-
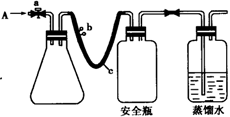
下列实验操作能够达到实验目的的是
A.实验室采用图①所示装置收集SO2
B.可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱[
C.除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤
D.称取0.40g NaOH,放入100 mL容量瓶中,配制0.10 mol/L NaOH溶液
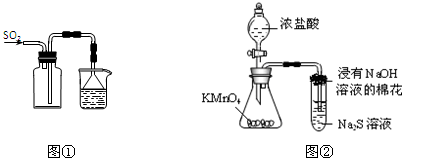
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下的33.6 L氯气与27 g铝充分反应,转移的电子数为3NA
B.标准状况下,0.5 NA 个NO和0.5 NA 个O2混合气体的体积约为22.4 L
C.一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目为2NA
D.在电解CuSO4溶液的实验中,测得电解后溶液pH=0,又知电解后溶液体积为1 L,在阳极析出的气体分子数约为0.25NA
难度: 简单查看答案及解析
-
某同学设计如下实验测量m g铜银合金样品中铜的质量分数:
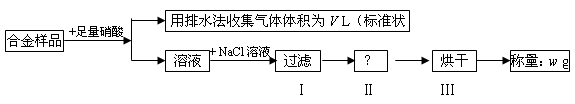
下列说法中不正确的是
A.收集到的V L气体为 NO
B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒
C.操作Ⅱ应是洗涤
D.铜的质量分数为:
×100%
难度: 简单查看答案及解析
-
下列图像表达正确的是
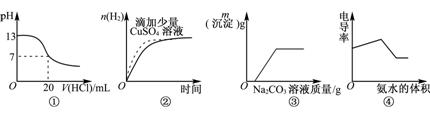
A.图①表示25℃时,用0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液
B.图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应
C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液
D.图④表示向盐酸和醋酸混合溶液中滴入氨水
难度: 简单查看答案及解析
-
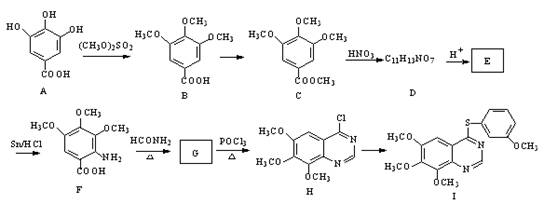
CPAE是蜂胶的主要活性成分,也可由咖啡酸合成
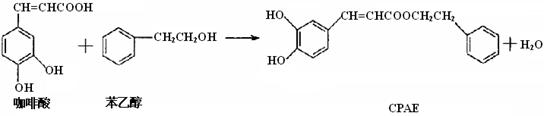
下列说法不正确的是
A.咖啡酸分子中所有原子可能处在同一个平面上
B.可用金属Na检测上述反应是否残留苯乙醇
C.1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2
D.1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH
难度: 简单查看答案及解析
-
下列判断中,正确的是( )
A.30%和H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂
B.SO2和CO2都属于酸性氧化物,Na2O和Al2O3都属于碱性氧化物[
C.在NH4Cl水溶液中,既存在水解平衡,又存在电离平衡
D.O2在放电条件下生成O3属于化学变化,煤干馏得到焦炭属于物理变化
难度: 简单查看答案及解析
-
图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池,则下列说法正确的是
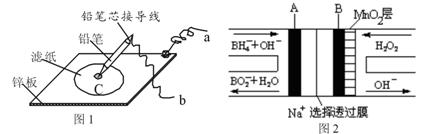
A.图2电池放电过程中,Na+从正极区向负极区迁移
B.图2电池负极区的电极反应为BH4-― 8e- + 8OH-=BO2- + 6H2O
C.若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则铅笔芯C点处出现红色
D.若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则b接的是A电极
难度: 简单查看答案及解析
-
常温下,下列各溶液的叙述中正确的是
A.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
B.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b
C.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH)
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
[c(Na+)-c(F一)]<[c(K+)-c(CH3COO一)]
难度: 简单查看答案及解析
-
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 3B(g)
2C(g) ΔH=-192 kJ·mol-1。向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y
B.若x∶y=1∶2,则平衡时,M中的转化率:A>B
C.若x∶y=1∶3,当M中放出热量172.8 kJ时,A的转化率为90%
D.若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时,v(正)<v(逆)
难度: 简单查看答案及解析