-
(13分)实验室用下列方法测定某水样中O2的含量。
(1)实验原理
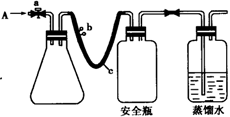
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为________。
再用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为: MnO(OH)2+2I—+4H+=Mn2++I2+3H2O。
然后用Na2S2O3 标准溶液滴定生成的I2,反应方程式为: I2+2Na2S2O3=2NaI+Na2S4O6。
(2)实验步骤
① 打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是________;
② 用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③ 再分别从A 处注入含m mol NaOH溶液及过量的MnSO4 溶液;
④ 完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤ 打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥ 重复④ 的操作。
⑦ 取下锥形瓶,向其中加入2~3滴________作指示剂;
⑧ 用0.005 mol · L—1Na2S2O3 滴定至终点。
(3)数据分析
①若滴定过程中消耗的Na2S2O3 标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________(单位:mg·L—1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将________(填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是________。
-
实验室用下列方法测定某水样中O2的含量。

(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,再用I-将生成的MnO(OH)2再还原为Mn2+,第二步反应的离子方程式为___________________。然后用Na2S2O3标准溶液滴定生成的I2。
已知:①2Mn2++O2+4OH-=2 MnO(OH)2 ②I2+2Na2S2O3=2NaI+Na2S4O6。
③S2O32-+2H+=SO2↑+S+H2O
(2)实验步骤
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是______________;
②用注射器抽取某水样20.00 mL从A 处注入锥形瓶;
③再分别从A 处注入含m mol NaOH溶液及过量的MnSO4 溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液使溶液接近中性;
⑥重复④的操作。
⑦取下锥形瓶,向其中加入2~3滴________________作指示剂;
⑧用0.005 mol`L-1Na2S2O3滴定至终点。
(3)数据分析
①若在滴定过程中消耗的Na2S2O3标准溶液体积为3.60 mL,则此水样中氧气(O2)的含量为___(单位:mg·L-1)。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将____________(填“偏大”、“偏小”或“不变”)。
③实验要求加入适量的H2SO4使溶液接近中性,其原因是__________________________。
-
实验室用下列方法测定某水样中O2的含量.
(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为______.再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O.然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6.
(2)实验步骤
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是______;
②用注射器抽取某水样20.00mL从A 处注入锥形瓶;
③再分别从A 处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A 处注入足量NaI溶液,并用稀H2SO4溶液调节pH至接近中性;
⑥______;
⑦取下锥形瓶,向其中加入2~3滴______作指示剂;
⑧用0.005mol•L-1Na2S2O3 滴定至终点.
(3)数据分析
①若滴定过程中消耗的Na2S2O3 标准溶液体积为3.90mL,则此水样中氧(O2)的含量为______.
②若未用Na2S2O3 标准溶液润洗滴定管,则测得水样中O2的含量将______(填“偏大”、“偏小”或“不变”).
③步骤⑤中加入适量的H2SO4使溶液接近中性,其原因是______.

-
实验室用下列方法测定某水样中O2的含量。
(1)实验原理
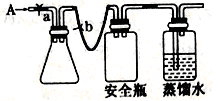
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为_____________________________。
②在酸性条件下,再用I-将生成的MnO(OH)2,还原为Mn2+,反应的离子方程式为_____________________________。然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为I2+2 Na2S2O3=2Na1+Na2S4O6。
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是___________________________;
②用注射器抽取某水样20. 00mL从A处注入锥形瓶;
③再分别从A处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸;
⑥重复④的操作;
⑦取下锥形瓶,向其中加入2〜3滴_______作指示剂;
⑧用0.005 mol • L -1 Na2S2O3溶液滴定至终点。滴定终点的现象是___________________________。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________ mg • L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将_________ (填“偏大”“偏小”或“不变”)。
-
实验室用下列方法测定某水样中O2的含量。

(1)实验原理
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为___________________________。
②在酸性条件下,再用I-将生成的MnO(OH)2还原为Mn2+,反应的离子方程式为___________________________________。然后用Na2S2O3标准溶液滴定生成I2,反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6。
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是____________________________________________;
……
⑦取下锥形瓶,向其中加入2~3滴________作指示剂;
⑧用0.005 mol·L-1Na2S2O3溶液滴定至终点。滴定终点的现象是_____________________________。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,已知水样的体积为20 mL,则此水样中氧(O2)的含量为________mg·L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将________(填“偏大”、“偏小”或“不变”)。
-
实验室用下列方法测定某水样中O2的含量。

(1)用如图所示装置,使水中溶解的O2在碱性条件下将Mn2+氧化成MnO(OH)2的反应的离子方程式为______________________________________。
实验步骤:
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是______________________________________。
②用注射器抽取20.00 mL某水样从A处注入锥形瓶。
③再分别从A处注入含m mol NaOH的溶液及过量的MnSO4溶液。
④完成上述操作后,下面应进行的操作是_______________。c是长橡胶管,使用较长橡胶管的目的是__________________________________。
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为MnO(OH)2+2I-+4H+===Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴__________作指示剂。
⑧用0.005 mol·L-1的Na2S2O3滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如图所示。

⑨经计算,此水样中氧(O2)的含量为________mg·L-1。
-
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组设计如图所示的实验装置 夹持装置略
夹持装置略 ,采用碘量法测定学校周边河水中的溶解氧的含量。
,采用碘量法测定学校周边河水中的溶解氧的含量。
实验步骤及测定原理如下:
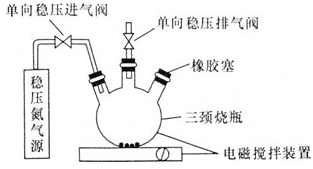
Ⅰ.取样、氧的固定
 用溶解氧瓶采集水样,记录大气压及水体温度。
用溶解氧瓶采集水样,记录大气压及水体温度。
 向烧瓶中加入200mL水样。
向烧瓶中加入200mL水样。
 向烧瓶中依次迅速加入
向烧瓶中依次迅速加入 无氧溶液
无氧溶液 过量
过量 和2mL碱性KI无氧溶液
和2mL碱性KI无氧溶液 过量
过量 ,开启搅拌器,反应生成
,开启搅拌器,反应生成 ,实现氧的固定。
,实现氧的固定。
Ⅱ 酸化、滴定
酸化、滴定
 搅拌,并向烧瓶中加入2mL硫酸无氧溶液至
搅拌,并向烧瓶中加入2mL硫酸无氧溶液至 被
被 还原为
还原为 ,溶液为中性或弱酸性。
,溶液为中性或弱酸性。
 在暗处静置5min后,取一定量溶液,用
在暗处静置5min后,取一定量溶液,用 标准溶液滴定生成的
标准溶液滴定生成的 ,记录数据。
,记录数据。

 处理数据
处理数据 忽略氧气从水样中的逸出量和加入试剂后水样体积的变化
忽略氧气从水样中的逸出量和加入试剂后水样体积的变化 。
。
回答下列问题:
 配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为________。
配制以上无氧溶液时,除去所用溶剂水中的氧气的简单操作为________。
 取水样时应尽量避免扰动水体表面,这样操作的主要目的是________。
取水样时应尽量避免扰动水体表面,这样操作的主要目的是________。
 “步骤c”中“搅拌”的作用是________。
“步骤c”中“搅拌”的作用是________。
 “氧的固定”中发生主要反应的化学方程式为________。
“氧的固定”中发生主要反应的化学方程式为________。
 “步骤f”为________。
“步骤f”为________。
 “步骤e”中,用amol/LNa2S2O3标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为________;若200mL水样经处理后,共消耗
“步骤e”中,用amol/LNa2S2O3标准溶液滴定,以淀粉溶液作指示剂,滴定终点的现象为________;若200mL水样经处理后,共消耗 标准溶液的体积为bmL,则水样中溶解氧的含量为________
标准溶液的体积为bmL,则水样中溶解氧的含量为________ 用含字母的式子表示)mg/L。
用含字母的式子表示)mg/L。
 “步骤d”中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因
“步骤d”中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因 用离子方程式表示,至少写出2个
用离子方程式表示,至少写出2个 :________。
:________。
-
水中的溶解氧是水生生物生存不可缺少的条件,某课外小组采用碘量法测定学校周边河水中的溶解氧,实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样,记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2 +I2=2I−+
+I2=2I−+ )。
)。
回答下列问题:
(1)氧的固定”中发生反应的化学方程式为_________________________________。
(2)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、胶头滴管、试剂瓶和_________________________,配制溶液定容时俯视会导致Na2S2O3溶液的浓度__________,(填“偏高”或“偏低”)蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除________________及二氧化碳。
(3)取100.00 mL水样经固氧、酸化后,用0.5 mol·L−1Na2S2O3溶液滴定,以_________作指示剂,如何判断该反应到达终点_________________________________________________;若反应中消耗Na2S2O3溶液的体积为10 mL,则水样中溶解氧的含量为_________mg·L−1。
(4)上述滴定完成时,若滴定前平视,滴定后仰视会导致测量结果___________。(填“偏高”或“偏低”)
-
水中溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化,滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2 S2O32−+I2=2I−+ S4O62−)。
回答下列问题:
(1)“氧的固定”中发生反应的化学方程式为__________________________________。
(2)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶、胶头滴管和______________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除_______及二氧化碳。
(3)取100.00 mL水样经固氧、酸化后,用a mol·L−1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为__________________________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为___________________mg·L−1。
-
水中溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化,滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2 S2O32−+I2=2I−+ S4O62−)。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)“氧的固定”中发生反应的化学方程式为_______________。
(3)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取100.00 mL水样经固氧、酸化后,用a mol·L−1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗Na2S2O3 溶液的体积为b mL,则水样中溶解氧的含量为_________mg·L−1。
(5)上述滴定完成后,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填“高”或“低”)





