-
化学与社会可持续发展密切相关。下列做法不合理的是
A.CO2合成可降解的聚碳酸酯类塑料,实现“碳循环”
B.提倡步行、骑自行车、乘公交车等“低碳”出行方式
C.将废电池深埋,防止重金属污染
D.开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.Cl-的结构示意图:
B.次氯酸的结构式:
C.CH3F的电子式:
D.CO2的分子比例模型:

难度: 中等查看答案及解析
-
常温下,下列溶液中各组离子一定能够大量共存的是
A.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.
=0.1 mol·L-1的溶液:Na+、K+、SiO32—、NO3—
D.通入足量SO2后的溶液:Na+、NH4+、ClO-、CH3COO-
难度: 困难查看答案及解析
-
下列关于反应过程中能量变化的说法正确的是
A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化
B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1
难度: 中等查看答案及解析
-
下列有关物质性质或应用的说法正确的是
A.制水泥和玻璃都用石灰石作原料
B.利用Al2O3制作的坩埚,可用于熔融烧碱
C.Si可用作太阳能电池和光导纤维的材料
D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是
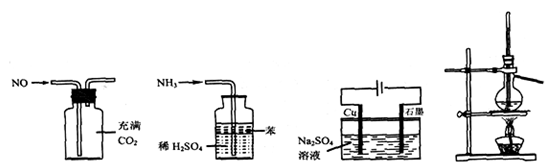
图1 图2 图3 图4
A.用图1所示装置(正放)可收集NO气体
B.用图2所示装置可吸收多余氨气且能防止倒吸
C.用图3所示装置可实现反应:Cu+2H2O
Cu(OH)2+H2↑
D.用图4所示装置可分离乙醇(沸点78.4℃)与二甲醚(沸点24.9℃)的混合物
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①氯化钠饱和溶液
NaHCO3(s)
②N2
NO2
HNO3
③海水
Mg(OH)2
MgCl2(aq)
MgCl2(s)
④Al2O3
AlCl3(aq)
Al(OH)3
⑤重晶石(BaSO4)
BaCO3
BaCl2(aq)
A.①③⑤ B.②③④ C.②④⑤ D.①④⑤
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.39g苯分子中含有的碳碳双键数为1.5NA
B.1molCH3COONa和少量CH3COOH溶于水所得中性溶液中,CH3COO-数目为NA
C.2.24LNH3中含共价键数目一定为0.3NA
D.5.6gFe投入100mL 3.5mol·L-1稀硝酸中,充分反应,转移电子总数为0.3 NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.向NaHS溶液中通入Cl2:S2-+Cl2=S↓+2Cl-
B.向NaNO2溶液中滴加酸性KMnO4溶液:5NO2-+2MnO4-+3H2O=5NO3-+2Mn2++6OH-
C.向NH4HSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
D.向偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
难度: 困难查看答案及解析
-
下列说法正确的是
A.除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
B.某温度时,纯水中c(H+)=2×10-7mol·L-1,则c(OH-)=5×10-8mol·L-1
C.N2(g)+3H2(g)
2NH3(g),其他条件不变,增大压强,v(正)增大而v(逆)减小
D.Na2CO3溶液中存在平衡:CO32-+H2O
HCO3-+OH一,升高温度溶液碱性增强
难度: 中等查看答案及解析
-
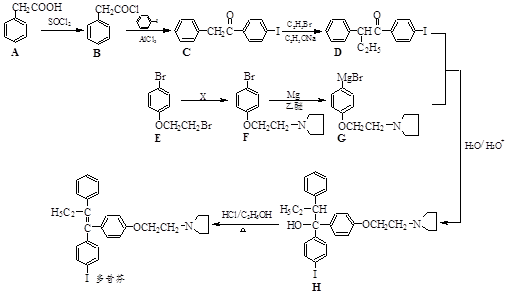
Cyrneine A对治疗神经系统疾病有着很好的疗效。可用香芹酮经过多步反应合成:
下列说法正确的是
A.香芹酮化学式为C9H12O
B.Cyrneine A可以发生加成反应、消去反应和氧化反应
C.香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色
D.与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种
难度: 困难查看答案及解析
-
X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素,X+是一个裸露的质子,X和Z处于同一主族,Y、Z的最外层电子数之和与Q的最外层电子数相等,W的最内层电子数和最外层电子数之和等于次外层电子数。下列说法正确的是
A.Y分别与X、Z以及W形成的化合物都不止一种
B.原子半径:rQ>rW>rZ>rY>rX
C.化合物XQ和ZQ中化学键的类型相同
D.Q的单质和水反应可生成两种酸
难度: 困难查看答案及解析
-
根据下列有关实验得出的结论一定正确的是
选项 方法 结论
A 同温时,等质量的锌粒分别与足量稀硫酸反应 产生氢气量:加过胆矾=没加胆矾
B 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,则溶液变黄 氧化性:H2O2>Fe3+
C 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 反应速率:粉状大理石>块状大理石
D 向2mL 0.1mol·L-1Na2S溶液中滴入几滴0.1mol·L-1ZnSO4溶液,有白色沉淀生成;再加入几滴0.1mol·L-1 CuSO4溶液,则又有黑色沉淀生成 溶度积(Ksp):ZnS>CuS
难度: 中等查看答案及解析
-
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
A.1L0.1mol·L—1(NH4)2Fe(SO4)2·6H2O的溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH—)+c(SO42—)
B.0.1 mol·L-1 NH4HS溶液中:c(NH4+)<c(HS-)+c(H2S)+c(S2-)
C.0.1mol·L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-)
D.等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+)
难度: 困难查看答案及解析
-
一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
甲
乙
丙
丁
密闭容器体积/L
2
2
2
1
起始物质的量
n(SO2)/mol
0.4
0.8
0.8
0.4
n(O2)/mol
0.24
0.24
0.48
0.24
SO2的平衡转化率/%
80
α1
α2
α3
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.该温度下,甲和乙中反应的平衡常数K均为400
C.SO2的平衡转化率:α1>α2=α3
D.容器中SO3的物质的量浓度:丙>甲=丁
难度: 困难查看答案及解析