-
80℃时,2 L密闭容器中充入0.40 mol N2O4,发生如下反应:N2O4(g)
2NO2(g)。一段时间后达到平衡,测得数据如下:
时间/s
20
40
60
80
100
c(NO2)/( mol·L−1)
0.12
0.20
0.26
0.30
0.30
请回答:
(1)20 s内,v(NO2) =_________mol/(L·s) −1。
(2)升高温度时,c(NO2)增大,则正反应是______(选填“放热”或“吸热”)反应。
(3)该温度下反应的化学平衡常数数值为______。
(4)该条件下N2O4的平衡转化率是______。
难度: 简单查看答案及解析
-
① C(s) +1/2O2(g) =CO(g) ∆H1 =-110.5 kJ·mol−1
② H2O(g) =1/2O2(g) +H2(g) ∆H2 =+241.8 kJ·mol−1
③ C(s) +H2O(g) =CO(g) +H2(g) ∆H3
请回答:
(1)反应①属于______(选填“吸热”或“放热”)反应。
(2)反应①消耗12 g C(s)时,∆H =______kJ·mol−1。
(3)反应②生成1 mol H2(g)时,∆H = ______kJ·mol−1。
(4)反应③的∆H3 =______kJ·mol−1。
难度: 简单查看答案及解析
-
有pH均为2的盐酸、硫酸、醋酸三瓶溶液
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是________________________(用“>、<、=”表示,下同)。
(2)取同体积的三种酸分别加蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是___________________________。
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是____________________________。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应过程中放出H2的速率依次为a1、a2、a3,则其关系是___________________________。
难度: 简单查看答案及解析
-
(1)1.00L 1.00mol•L﹣1H2SO4溶液与2.00L 1.00mol•L﹣1 NaOH溶液完全反应,放出114.6kJ热量,该反应的中和热△H为_____,表示其中和热的热化学方程式为_____。
(2)在25℃、101KPa时,1.00g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8kJ的热量,C6H6的燃烧热为_____kJ•mol﹣1,该反应的热化学方程式为_____。
(3)化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
已知AX3的熔点和沸点分别为﹣93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1mol AX5,放出热量123.8kJ.该反应的热化学方程式为_____。
难度: 简单查看答案及解析
-
现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下表:
实验分组
所用金属
电子流向
①
A、Cu
A→Cu
②
C、D
D→C
③
A、C
C→A
④
B、Cu
Cu→B
⑤
……
……

根据上述情况,回答下列问题:
(1)五种金属的活动性按从大到小的顺序是____________________。
(2)在①中,Cu片上观察到的现象是____________________。
(3)在②中,溶液中H+向金属片________移动。
(4)如果实验⑤用B、D作电极,则导线中电流方向为________(填“B→D”或“D→B”)。
难度: 简单查看答案及解析
-
在400℃、101 kPa时,NO2(g) +CO(g)=NO(g) + CO2(g) 反应过程的能量变化如下图所示。
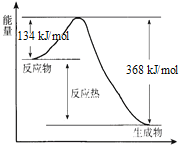
反应过程
(1)该反应是_____________(填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为_____________。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是_____________。
a.浓度 b.压强 c.温度 d.催化剂
(4)反应体系中加入催化剂对反应热是否有影响?____(填“是”或“否”),原因是____。
难度: 简单查看答案及解析
-
在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)
3C(g)+2D(g),开始时A为4 mol,B为6 mol;5 min末时测得C的物质的量为3 mol。请计算:
(1)5min末A的物质的量浓度___________________;
(2)5min内D的平均化学反应速率____________________;
(3)B的转化率_____________________________;
(4)反应后容器中的总压强与反应前总压强之比为_________________。
难度: 简单查看答案及解析
-
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
化学反应
焓变
平衡常数
温度/℃
500
700
800
①2H2(g)+CO(g)
CH3OH(g)
ΔH1
K1
2.5
0.34
0.15
②CO2(g)+H2(g)
CO(g)+H2O(g)
ΔH2
K2
1.0
1.70
2.52
③CO2(g)+3H2(g)
CH3OH(g)+H2O(g)
ΔH3
K3
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v正________v逆(填“>”、“=”或“<”)。
难度: 简单查看答案及解析
-
可逆反应A(g)+B(g)
2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。

①由T1向T2变化时,正反应速率______逆反应速率(填“>”“<”或“=”)。
②由T3向T4变化时,正反应速率______逆反应速率(填“>”“<”或“=”)。
③反应在________温度下达到平衡。
难度: 简单查看答案及解析
-
CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为________________。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为______________。

(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
①在图示2的转化中,化合价不变的元素是_________(填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
③加入NaClO时发生的反应为:Cu(NH3)42++2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有________、________。
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式:____________。

难度: 简单查看答案及解析
-
如下图所示,烧杯中都盛有稀硫酸。
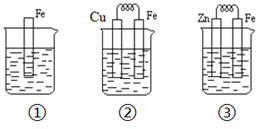
(1)①中反应的离子方程式为________。
(2)②中的电极反应:Fe极:_____、Cu极:_____,Cu极附近溶液的pH____(填增大、减小或不变)。
(3)③中作负极的金属是____,其电极反应式为_______。比较①、②、③中纯铁被腐蚀的速率由快到慢的顺序______(用序号回答)。
难度: 简单查看答案及解析
-
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知CO(g)+H2O(g)
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
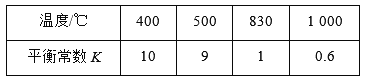
试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母)。
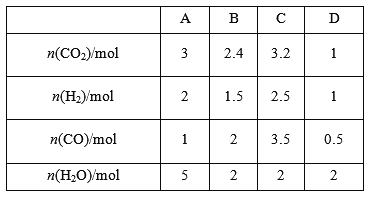
(4)在830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
难度: 简单查看答案及解析
-
CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)
CO(g)+3H2(g)。
(1)每消耗8g CH4转移的电子的数目为 。
(2)已知:①2CO(g)+O2(g)=2CO2(g) △H1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=ckJ·mol-1
④CH4(g)+H2O(g)
CO(g)+3H2(g) △H4
由此计算△H4= kJ·mol-1。
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g)
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
①0~tmin内,该反应的平均反应速率v(H2)= 。②T℃时,该反应的平衡常数K= 。
③当温度升高到(T+100)℃时,容器中c(CO)="0.75" mol·L-1,则该反应是 反应(填“吸热”或“放热”)。
(4)已知熔融碳酸盐燃料电池的工作原理示意图如下:
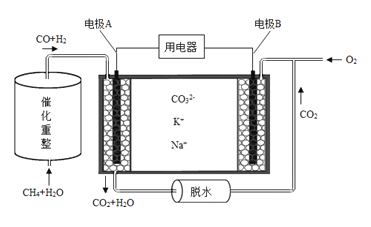
①放电过程中K+和Na+向电极 (填“A”或“B”)移动。
②该电池的负极反应式为 。
难度: 困难查看答案及解析
-
经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
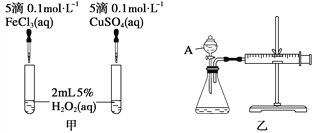
(1)定性分析:
①如图甲可通过观察_____________________________________,定性比较得出结论。
②有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________,
③若H2O2在二氧化锰催化作用下发生反应,曾检测出有物质MnO3出现,写出整个反应过程的两个化学方程式:___________________________,________________________。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是_________________。
难度: 简单查看答案及解析
-
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)。污染跟冬季燃煤密切相关,SO2.CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)工业上可用CO2和H2反应合成甲醇。已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1=-242kJ/mol
CH3OH+3/2O2(g) =CO2(g)+2H2O △H2=-676kJ/mol
写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式_________________。
(2)工业上还可以通过下列反应制备甲醇:CO (g) +2H2 (g)
CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。

①下列说法不能判断该反应达到化学平衡状态的是____(填字母)。
a. H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA____PB(填“>”“<”或“=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20molH2,则在平衡状态B时容器的体积V(B)=________L。
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图:
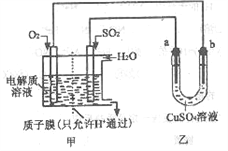
①该电池的负极反应:___________________;
②当甲中消耗2.24LO2(标准状况)时,乙中a极增重____g。
难度: 简单查看答案及解析
-
为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:
利用如图装置测定化学反应速率(已知:S2O32-+2H+═H2O+S↓+SO2↑)

(1)除如图装置所示的实验用品外,还需要的一种实验用品是________。
A.温度计 B.秒表 C.酒精灯
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是__________。
实验二:
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
实验序号
体积V/mL
时间/s
Na2S2O3溶液
淀粉溶液
碘水
水
①
10.0
2.0
4.0
0.0
t1
②
8.0
2.0
4.0
2.0
t2
③
6.0
2.0
4.0
Vx
t3
(3)表中Vx=____mL,t1、t2、t3的大小关系是________。
实验三:
取5mL0.1mol/L的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液溶液2mL,发生如下反应:2Fe3++2I-==2Fe2++I2.为证明该反应达到一定可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色(AgI)沉淀;
②再取少量反应液,滴加少量CCl4,振荡,发现CCl4层显浅紫色.
根据①②的现象,他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度.
(4)指导老师指出他们上述实验中①不合理,你认为其原因是__________;改进的方法是_______。
(5)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是____________________。
难度: 简单查看答案及解析
-
完成下列各题.
(1)常温下,浓度均为 0.1mol•L﹣1 的下列五种钠盐溶液的 pH如表;
溶质
CH3COONa
NaHCO3
Na2CO3
NaClO
NaCN
pH
8.8
9.7
11.6
10.3
11.1
上述盐溶液中的阴离子,结合H+能力最强的是___________,根据表中数据,浓度均为0.01mol•L﹣1 的下列四种酸的溶液分别稀释 100倍,pH变化最大的是___________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100ml 0.1mol/L NaHCO3②100ml 0.1mol/L Na2CO3 两种溶液:
溶液中水电离出的OH-个数:①_________②(填“>”、“=”或“<”,下同)。溶液中阴离子的物质的量浓度之和:①__________②。
(3)NaCN遇水可产生易燃的HCN气体,浓度均为0.1mol/L的NaCN和HCN的混合液中滴加酚酞,溶液变红,则混合液中各离子的浓度大小关系为_______________________。
(4)研究证实,CO2可在酸性水溶液中通过电解生成甲醇(CH3OH),则生成甲醇的反应发生在_______ (填阴极或阳极),该电极反应式是_________________。
(5)已知Ksp(CuS)=1.3×10-36,Ksp(NiS)=1.0×10-24;在含Cu2+,Ni2+的溶液中,当Ni2+恰好完全沉淀[此时溶液中c(Ni2+)=1.0×10-5 mol·L-1],溶液中Cu2+的浓度是_____________mol·L-1。
难度: 简单查看答案及解析
-
(1)已知常温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH=________,此酸的电离平衡常数K=________,由HA电离出的H+的浓度约为水电离出的H+的浓度的________倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是________________,向其中加入少量KOH溶液时,发生反应的离子方程式是________________。
②现将0.02 mol·L-1 HA溶液和0.01 mol·L-1 NaOH溶液等体积混合,得到缓冲溶液。
a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)________c(CN-)(填“<”、“=”或“>”)。
b.若HA为CH3COOH,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是____________________________。
难度: 简单查看答案及解析
-
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。有如下的A~G请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,实验测得A的pH<7,原因是(用离子方程式表示):________________;在该溶液中各种离子浓度由大到小的顺序为_______________。
(2)B为0.1 mol·L-1 NaHCO3溶液,实验测得B的pH>7,请分析B显碱性的原因:________。
(3)C为Al2(SO4)3溶液,把C蒸干,灼烧,最后得到的固体产物是________。若把B和C混合,将产生白色沉淀和无色气体,该反应的离子方程式为__________________。
(4)D为CH3COONa溶液,常温下,pH=9的D中,水电离出来的c(OH-)=________。
(5)E为某浓度的NH4Cl溶液,常温下, 测得该溶液的pH=5,写出该溶液中下列算式的精确结果(列式):c(Cl-)-c(NH4+)=_____________ mol/L。
(6)F为Mg(OH)2溶液,求室温下F饱和溶液中Mg2+的物质的量浓度=___________mol/L(已知室温时,Mg(OH)2的溶度积Ksp=3.2×10-11)。
(7)G为硫化钠溶液,在配制G时,为了防止发生水解,可以加入少量的_________ 。
难度: 简单查看答案及解析