-
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)。污染跟冬季燃煤密切相关,SO2.CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)工业上可用CO2和H2反应合成甲醇。已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1=-242kJ/mol
CH3OH+3/2O2(g) =CO2(g)+2H2O △H2=-676kJ/mol
写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式_________________。
(2)工业上还可以通过下列反应制备甲醇:CO (g) +2H2 (g) CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。

①下列说法不能判断该反应达到化学平衡状态的是____(填字母)。
a. H2的消耗速率等于CH3OH的生成速率的2倍
b.H2的体积分数不再改变
c.体系中H2的转化率和CO的转化率相等
d.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA____PB(填“>”“<”或“=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 mol CO和20molH2,则在平衡状态B时容器的体积V(B)=________L。
(3)SO2在一定条件下可与氧气构成原电池。下图是利用该电池在铁表面镀铜的装置示意图: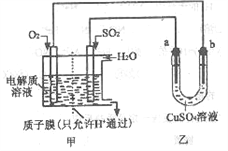
①该电池的负极反应:___________________;
②当甲中消耗2.24LO2(标准状况)时,乙中a极增重____g。
-
(6分)PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池正极反应式为__________________。
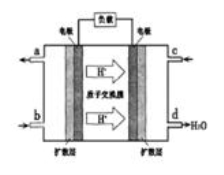
-
(20分)PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)在一个密闭容器中,发生反应:C(s)+H2O(g)  CO(g)+H2(g)则该反应正向反应是: 反应(填:放热、吸热),该反应化学平衡常数表达式为K= ,达到平衡后,若减小密闭容器的容积,保持温度不变,原化学平衡向 反应方向移动,v(正) (填:不变、变大、变小)。
CO(g)+H2(g)则该反应正向反应是: 反应(填:放热、吸热),该反应化学平衡常数表达式为K= ,达到平衡后,若减小密闭容器的容积,保持温度不变,原化学平衡向 反应方向移动,v(正) (填:不变、变大、变小)。
(2)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇(CH3OH)。
①已知在常温常压下:2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ∆H = -566.0 kJ/mol
H2O(g)=H2O(1) ∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从 (填“c”或“b”)口通入,电池负极反应式为_______________________________。
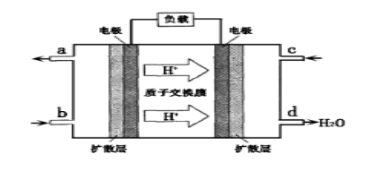
(3)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g) ΔH<0 若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是______________。
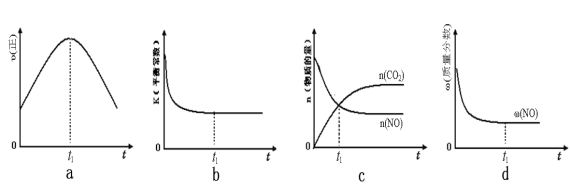
(4)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,0.5分钟后达到平衡,测得容器中含SO3 0.18mol,则v(O2)=________mol/(L•min),若继续通入0.20mo1SO2和0.lmolO2,则达平衡时SO2的转化率_______(填“不变”、“增大”“减小”)
(5)25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
-
化学与环境、能源密切相关,下列叙述不正确的是
A. 燃煤产生的PM2.5(2.5微米以下细颗粒物)属于大气污染物
B. 开发利用各种新能源,可以减少对化石燃料的依赖
C. 废电池必须进行集中处理,其首要原因是利用电池外壳的金属材料
D. “富煤、贫油、少气”是我国能源发展面临的现状,解决的办法是开源节流
-
化学与生活密切相关。下列说法错误的是( )
A. PM2.5是指粒径不大于2.5 μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
-
化学与生活密切相关。下列说法错误的是( )
A. PM2.5是指粒径不大于2.5 μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
-
化学与生活密切相关。下列说法错误的是( )
A. PM2.5是指粒径不大于2.5 μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
-
化学与生活密切相关。下列说法错误的是( )
A. PM2.5是指粒径不大于2.5 μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
-
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是
A.朝鲜第三次核试验产生的放射性物质的衰变为化学变化
B.燃烧化石燃料排放的废气中含大量CO2、SO2,形成酸雨
C.为防止垃圾污染城市,可采用露天焚烧或深埋的方法进行处理
D.用高纯度二氧化硅制作的光导纤维遇强碱会“断路”
-
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是
A.朝鲜第三次核试验产生的放射性物质的衰变为化学变化
B.燃烧化石燃料排放的废气中含大量CO2、SO2,形成酸雨
C.为防止垃圾污染城市,可采用露天焚烧或深埋的方法进行处理
D.用高纯度二氧化硅制作的光导纤维遇强碱会“断路”
CH3OH (g)。在一容积可变的密闭容器中充入l0molCO和20molH2,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。




