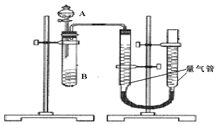
-
为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:
利用如图装置测定化学反应速率(已知:S2O32-+2H+═H2O+S↓+SO2↑)

(1)除如图装置所示的实验用品外,还需要的一种实验用品是________。
A.温度计 B.秒表 C.酒精灯
(2)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是__________。
实验二:
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2S2O32-═S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s |
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 |
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(3)表中Vx=____mL,t1、t2、t3的大小关系是________。
实验三:
取5mL0.1mol/L的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液溶液2mL,发生如下反应:2Fe3++2I-==2Fe2++I2.为证明该反应达到一定可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色(AgI)沉淀;
②再取少量反应液,滴加少量CCl4,振荡,发现CCl4层显浅紫色.
根据①②的现象,他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度.
(4)指导老师指出他们上述实验中①不合理,你认为其原因是__________;改进的方法是_______。
(5)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是____________________。
-
某化学兴趣小组进行以下实验探究:
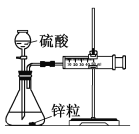
Ⅰ. 设计实验探究反应速率的测定和比较
实验步骤:
(1)取一套装置(装置如图所示),加入40 mL 1 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
(2)取另一套装置,加入40 mL 4 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
实验现象: 锌跟硫酸反应产生气泡,收集10 mL气体,(2)所用时间比(1)所用时间________(填“长”或“短”);
实验结论: 4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应速率______(填“大”或“小”)。
注意事项:① 锌粒的颗粒(即表面积)大小________________;
② 40 mL的硫酸要迅速加入;
③ 装置____________________,且计时要迅速准确;
④ 气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有(任写一种)
________________________________________________________________。
Ⅱ. 探究用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素,所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T(K) | 大理石规格 | HNO3浓度 (mol·L-1) | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (1)实验①和②探究HNO3浓度对该反应速率的影响 (2)实验①和_____探究温度对该反应速率的影响 (3)实验①和_____探究大理石规格(粗、细)对该反应速率的影响 |
| ② | _____ | ________ | _________ |
| ③ | _____ | 粗颗粒 | _________ |
| ④ | ______ | ______ | ________ |
-
为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。
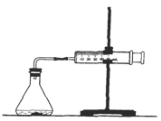
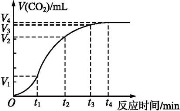
(1)化学反应速率最快的时间段是 ,影响此时间段反应速率的主要因素是 ;
A.O~t1 B.t1~t2 C.t2~t3 D.t3~t4
(2)为了减缓上述反应速率,欲向盐酸中加入下列物质,你认为可行的有 ;
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.通入HCl
(3)若盐酸的体积是20 mL,图中CO2的体积是标准状况下的体积,则t1~t2时间段平均反应速率v(HCl)= mol·(L·min)-1。
-
化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。(已知:S2O32-+2H+ = H2O+S↓+SO2↑)
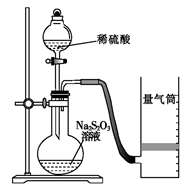
(1) 为保证实验准确性、可靠性,利用该装置 进行实验前应先进行的步骤是 ;除如图所示的实验用品、仪器外,还需要的一件实验仪器是______ 。
进行实验前应先进行的步骤是 ;除如图所示的实验用品、仪器外,还需要的一件实验仪器是______ 。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是 。
(3)试简述测定该反应的化学反应速率的其他方法(写一种):
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。
(已知 I2+2S2O32- = S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s |
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 |
| ① | 10.0 | 2.0[ | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
| | | | | |
(4)该实验进行的目的是 ,表中Vx= mL,比较t1、t2、t3大小,试推测该实验结论:
-
化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。(已知:S2O32-+2H+===H2O+S↓+SO2↑)
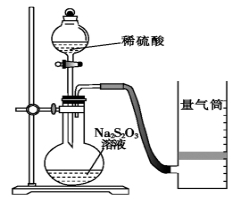
(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是_____________________;除如图装置所示的实验用品、仪器外,还需要的一件实验仪器是______________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是________________________。
(3)试简述测定该反应的化学反应速率的其他方法:__________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。
(已知 I2+2S2O32-===S4O62-+2I-,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s |
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 |
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
| | | | | |
(4)该实验进行的目的是_____________淀粉溶液的作用是____________。表中Vx==_______mL,比较t1、t2、t3大小,试推测该实验结论:___________________________
-
化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。
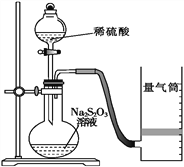
(1)除如图装置所示的实验用品外,还需要的一件实验用品是______________。
(2)圆底烧瓶中所发生反应的离子方程式为___________。
(3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(4)利用该化学反应,试简述测定反应速率的其他方法:________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2 Na2S2O3=== Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s |
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 |
| ① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(5)表中Vx=__________mL,T1、T2、T3的大小关系是____________________________。
-
化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定反应速率(药品:稀硫酸、Na2S2O3溶液等)。
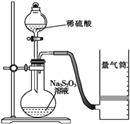
(1)除如图装置所示的实验用品外,还需要的一件实验仪器用品是________________;请写出在圆底烧瓶中所发生反应的离子方程式为___________________________________________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(3)利用该化学反应,试简述测定反应速率的其他方法:___________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知 I2+2 Na2S2O3= Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s |
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 |
| ① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(4)表中Vx=__________mL,该实验中加入淀粉的目的为_______________________;请判断T1、T2、T3的大小关系,并总结实验所得出的结论__________________________。
-
化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定反应速率(药品:稀硫酸、Na2S2O3溶液等)。
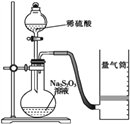
(1)除如图装置所示的实验用品外,还需要的一件实验仪器用品是________________;请写出在圆底烧瓶中所发生反应的离子方程式为___________________________________________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(3)利用该化学反应,试简述测定反应速率的其他方法:___________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知 I2+2 Na2S2O3= Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
| 实验序号 | 体积V/mL | 时间/s |
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 |
| ① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(4)表中Vx=__________mL,该实验中加入淀粉的目的为_______________________;请判断T1、T2、T3的大小关系,并总结实验所得出的结论__________________________。
-
化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
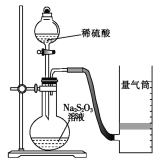
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。
(1)写出该反应的离子方程式 ___________________________________________________;为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是______________;除如图所示的实验用品、仪器外,还需要的一件实验仪器是__________________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________________。
(3)试简述测定该反应的化学反应速率的其他方法:_______________________________________________(写一种)。
Ⅱ.为探讨化学反应速率的影响因素,某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(4)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和______探究温度对该反应速率的影响; (Ⅲ)实验①和______探究大理石规格(粗、细)对该反应速率的影响。 |
| ② | _______ | 粗颗粒 | ______ |
| ③ | ____ | ___ | 2.00 |
| ④ | 298 | ________ | _____ |
-
甲、乙两个实验小组利用 酸性溶液与
酸性溶液与 溶液反应研究影响反应速率的因素。
溶液反应研究影响反应速率的因素。
设计实验方案如下 实验中所用
实验中所用 溶液均已加入
溶液均已加入 :
:
甲组:通过测定单位时间内生成 气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
| 序号 | A溶液 | B溶液 |
| ① |  溶液 溶液
|  溶液 溶液
|
| ② |  溶液 溶液
|  溶液 溶液
|
| ③ |  溶液 溶液
|  溶液和少量 溶液和少量
|
 该反应的离子方程式为 ______
该反应的离子方程式为 ______
 实验开始前需要检查气密性.分液漏斗中A溶液应该 ______ 加入
实验开始前需要检查气密性.分液漏斗中A溶液应该 ______ 加入 填“一次性”或“逐滴滴加”
填“一次性”或“逐滴滴加”
 完成该实验还需要 ______
完成该实验还需要 ______  填仪器名称
填仪器名称 ,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
乙组:通过测定 溶液褪色所需时间的多少来比较化学反应速率为了探究
溶液褪色所需时间的多少来比较化学反应速率为了探究 与
与 浓度对反应速率的影响,某同学在室温下完成以下实验
浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水 | 10 | 5 | 0 | X |
| 
| 5 | 10 | 10 | 5 |
| 
| 5 | 5 | 10 | 10 |
| 时间 | 40 | 20 | 10 | --- |
 ______ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 ______ 。
______ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 ______ 。
 号反应中,
号反应中, 的反应速率为 ______。
的反应速率为 ______。
 在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
| 时间 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度℃ | 25 | 26 | 26 | 26 | 
| 27 | 27 |
结合实验目的与表中数据,你得出的结论是 ______。
 从影响化学反应速率的因素看,你的猜想还可能是 ______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 ______
从影响化学反应速率的因素看,你的猜想还可能是 ______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 ______  填字母
填字母 。
。
A 硫酸钾  水
水  二氧化锰
二氧化锰  硫酸锰。
硫酸锰。