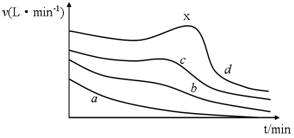
-
下列说法不正确的是
A.化学反应过程中的能量变化除了热能外,也可以是光能、电能等
B.吸热反应一定不能在常温下进行
C.需要加热才能进行的反应不一定是吸热反应
D.反应物总能量高于生成物总能量的反应是放热反应
难度: 简单查看答案及解析
-
已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol。下列关于中和热的说法中正确的是
A.在稀溶液中所有酸和碱反应的中和热数值都相等
B.在稀溶液中1mol酸和1mol碱反应放出的热量都相等
C.在稀溶液中HCl和NaOH反应、HNO3和KOH的反应的中和热相等
D.将浓硫酸滴入稍过量的氢氧化钠溶液中刚好生成1mol水时,产生的热量即中和热
难度: 简单查看答案及解析
-
一定温度下,固定体积的容器中充入1molSO2和1molO2,再加入少量的NO,在体系中发生①2NO+O2=2NO2;②SO2+NO2=SO3+NO,下列说法错误的是
A.体系中的总反应是:2SO2+ O2
2SO3
B.在反应过程中NO是催化剂
C.NO参与反应历程,降低反应活化能,加快反应速率
D.NO的引入可以增加SO2的平衡转化率
难度: 简单查看答案及解析
-
相同温度条件下,c(H+)均为0.1mol/L的①盐酸②醋酸溶液各100mL分别和0.3g 锌反应,下列说法中正确的是
A.①中锌消失的快 B.②锌消失的快
C.①中产生的氢气多 D.②中产生的氢气多
难度: 简单查看答案及解析
-
作为应对油气时代过后能源问题的一条解决途径,甲醇受到越来越多的关注。已知在常温常压条件下,1gCH3OH(l)完全燃烧释放出22.7kJ的热量,则表示甲醇燃烧热的热化学方程式为
A.CH3OH(l) +
O2(g) == CO2(g) + 2H2O(l);△H=-726.4kJ/mol
B.2CH3OH(l) + 3O2(g) == 2CO2(g) + 4H2O(g);△H=-1452.8kJ/mol
C.CH3OH(l) +
O2(g) == CO2(g) + 2H2O(l);△H=726.4kJ/mol
D.2CH3OH(l) + 3O2(g) == 2 CO2(g) + 4H2O(l);△H=-1452.8kJ/mol
难度: 简单查看答案及解析
-
一定温度下,在体积为10L的密闭容器中,2molO2和2molSO2混合气体发生如下反应:2SO2(g)+ O2(g)
2SO3(g),半分钟后,体系中O2的物质的量变为1.4mol,则此反应的平均速率为
A.v(O2) = 0.002mol/(L•s) B.v(SO2) = 0.002 mol/(L•s)
C.v(O2) = 0.02 mol/(L•s) D.v(SO3) = 0.04 mol/(L•s)
难度: 简单查看答案及解析
-
同温同压下,下列各组热化学方程式中,△H1<△H2是
A.C(s)+
O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
B.
H2(g)+
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
D.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g); △H2
难度: 简单查看答案及解析
-
参照反应Br + H2
HBr +H的能量对反应历程的示意图,下列叙述中正确的
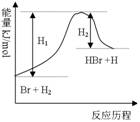
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热改变
C.正反应为吸热反应
D.加入催化剂可增大正反应速率,降低逆反应速率
难度: 简单查看答案及解析
-
下列热化学方程式中的反应热下划线处表示燃烧热的是
A.C6H12O6(s)+6O2(g)
6CO2(g)+6H2O(l);ΔH=-akJ·mol-1
B.CH3CH2OH(l)+
O2(g)
CH3CHO(l)+H2O(l);ΔH=-bkJ·mol-1
C.CO(g)+
O2(g)
CO2(g);ΔH=-c kJ·mol-1
D.NH3(g)+
O2(g)
NO(g)+
H2O(g);ΔH=-d kJ·mol-1
难度: 简单查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
A.增加CO的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
难度: 简单查看答案及解析
-
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图,下列描述正确的是
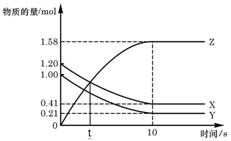
A.t秒时该反应达到各物质浓度不变状态
B.反应开始到10 s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g) + Y(g)
Z(g)
难度: 简单查看答案及解析
-
容积固定的2L密闭容器中进行的某一可逆反应A(g)+2B(g)
2C(g),以B的物质的量浓度表示的反应速度υ正、υ逆与时间的关系图如所示,则图中阴影部分的面积可表示
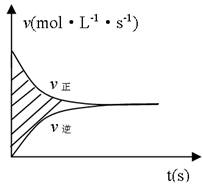
A.A的物质的量浓度的减少 B.B的物质的量浓度的减少
C.C的物质的量的增加 D.B的物质的量减少
难度: 简单查看答案及解析
-
烯烃存在顺反异构现象,已知:
①
△H=-119.6kJ/mol
②
△H=-115.6kJ/mol
下列说法中正确的是
A.上述两个反应中,反应物的总能量均低于生成物的总能量
B.上述两个反应中,破坏旧键需要的能量均大于形成新键所释放的能量
C.从上述反应热数据可知顺-2-丁烯比反-2-丁烯稳定
D.顺-2-丁烯转化为反-2-丁烯的反应热可表示为
△H=-4.0kJ/mol
难度: 简单查看答案及解析
-
在酸性条件下H2C2O4可以被KMnO4溶液氧化,使KMnO4溶液褪色,依据KMnO4溶液褪色时间的长短可以比较反应进行的快慢。下列各组实验中溶液褪色最快的是
组号
反应温度
/℃
参加反应物质
KMnO4
H2C2O4
MnSO4
V/mL
c/mol·L-1
V/mL
c/mol·L-1
m/g
A
20
4
0.1
2
0.1
0
B
20
4
0.1
2
0.1
0.1
C
40
4
0.1
2
0.1
0
D
40
4
0.1
2
0.2
0.1
难度: 简单查看答案及解析