-
一定温度下,对可逆反应A(g)+2B(g)
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. 单位时间内消耗a mol A,同时生成3a mol C B. 当3v(B)正 = 2v(C)逆
C. 容器内的压强不再变化 D. 混合气体的物质的量不再变化
难度: 简单查看答案及解析
-
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A.该反应的化学方程式为3B+2D ⇌6A+4C
B.反应进行到1 s时,v(A)=3v(D)
C.反应进行到6 s时,B的平均反应速率为0.1mol/(L•s)
D.反应进行到6 s时,各物质的反应速率相等
难度: 简单查看答案及解析
-
下列热化学方程式中,ΔH能正确表示物质的燃烧热的是( )
A.CO(g)+1/2O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
B.C(s)+1/2O2(g)====CO(g) ΔH=-110.5 kJ·mol-1
C.H2(g)+1/2O2(g)====H2O(g) ΔH=-241.8 kJ·mol-1
D.2C8H18(l)+25O2(g)====16CO2(g)+18 H2O(l) ΔH=-11036 kJ·mol-1
难度: 中等查看答案及解析
-
一定温度下,将2 mol SO2 和1 mol O2 充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)
2SO3(g) ,当达到平衡状态时,下列说法中正确的是( )
A. SO2 和O2 的转化率之比为2:1
B. 若不断移走SO3,正反应方向的速率不会变化
C. SO2和SO3 物质的量之和为2 mol
D. 平衡时SO2的物质的量和SO3 物质的量一定相等
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生反应:2A(g)+B(g)
2C(g),经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是( )
A.用物质A表示反应的平均速率为0.3 mol·L-1·s-1
B.用物质B表示反应的平均速率为0.3 mol·L-1·s-1
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.3 mol·L-1
难度: 中等查看答案及解析
-
在恒温下的密闭容器中,有可逆反应:2NO2
N2O4,下列不能说明反应达到了平衡状态的是 ( )
A.N2O4生成速率与N2O4分解速率相等时
B.混合气体平均相对分子质量保持不变时
C.NO2的分子数与N2O4分子数比为2∶1时
D.体系颜色不再发生改变时
难度: 中等查看答案及解析
-
已知: ①C(s)+H2O(g)=CO(g)+H2(g) ΔH=akJ·mol-1
② C(s)+ 1/2 O2(g) =CO(g) ΔH=-110kJ·mol-1
H-H、O=O和O-H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462kJ·mol-1,则a为
A.-332 B.-118
C.+350 D.+130
难度: 简单查看答案及解析
-
下列关于化学反应速率的说法正确的是( )
①恒温时,增大压强,化学反应速率一定加快②其他条件不变,温度越高,化学反应速率越快
③使用催化剂可改变反应速率,从而改变该反应过程中吸收或放出的热量④3mol·L﹣1·s﹣1的反应速率一定比1mol·L﹣1·s﹣1的反应速率大⑤升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数⑥有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大⑦增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多⑧催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率.
A. ②⑤ B. ②⑥⑧ C. ②③⑤⑦⑧ D. ①②④⑤⑧
难度: 困难查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
①由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
②增大压强可加快SO2转化为SO3的速率
③黄绿色的氯水光照后颜色变浅
④在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
⑤对平衡体系H2(g)+I2(g)
2HI(g)加压后,混合气体的颜色加深
A. ①③④ B. ②⑤ C. ①⑤ D. ①②④
难度: 困难查看答案及解析
-
下列有关热化学方程式的叙述中,正确的是 ( )
A.含20.0g NaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中[和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ/mol
B.已知热化学方程式:SO2(g)+
O2(g)
SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol
D.已知①S(s)+O2(g)=SO2(g); △H1 ②S(g)十O2(g)=SO2(g);△H2 则△H1>△H2
难度: 中等查看答案及解析
-
探究浓度对化学平衡的影响,实验如下:
I.向5mL 0.05mol·L-1 FeCl3溶液中加入5mL 0.05mol·L-1 KI溶液(反应a),平衡后分为两等份
Ⅱ.向一份加入饱和KSCN溶液,变红(反应b);加入CCl4,振荡、静置,下层显极浅的紫色
Ⅲ.向另一份加入CCl4,振荡、静置,下层显紫红色
结合实验,下列说法不正确的是( )
A. 反应a为:2Fe3++ 2I-
2Fe2++I2
B. Ⅱ中,反应a进行的程度大于反应b
C. 实验Ⅱ中变红的原理是:Fe3+ + 3SCN-
Fe(SCN)3
D. 比较水溶液中c(Fe2+):Ⅱ<Ⅲ
难度: 中等查看答案及解析
-
已知下列反应的热化学方程式为:
⑴C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ/mol
⑵CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH2=-870.3kJ/mol
⑶H2(g)+1/2 O2(g)=H2O(l) ΔH3=-285. 8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的焓变(ΔH)为
A. + 488.3 kJ/mol B. -488.3 kJ/mol
C. -244.15 kJ/mol D. + 244.15 kJ/mol
难度: 困难查看答案及解析
-
一定条件下,体积为10L的密闭容器中,2molX和1molY进行反应:2X(g)+Y(g)
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
A. 若压强增大1倍,则物质Y的转化率增大1倍
B. 将容器体积变为20L,Z的平衡浓度变为原来的
C. 若升高温度,X的浓度增大,则该反应的正反应为吸热反应
D. 以X浓度变化表示的反应速率为0.001mol·L-1·s-1
难度: 中等查看答案及解析
-
真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①Al2O3(s)+3C(s)=2Al(s)+3CO(g) △H1=1344.1kJ·mol-1
②2AlCl3(g)=2Al(s)+3Cl2(g) △H2=1169.2kJ·mol-1
③Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g) △H3=QkJ·mol-1
下列有关说法正确的是( )
A.反应①中化学能转化为热能
B.反应②中若生成液态铝则反应热应大于△H2
C.反应③中1molAlCl3(g)生成时,需要吸收174.9kJ的热量
D.该生产工艺中能循环利用的物质只有AlCl3
难度: 困难查看答案及解析
-
在一定条件下,反应A2 + B2
2AB △H= Q kJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
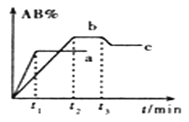
A. Q >0
B. A2、B2中最少有一种是气态物质
C. b对应的平衡状态时化学反应速率比c对应的平衡状态时化学反应速率大
D. AB一定是气体物质
难度: 困难查看答案及解析
-
下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为△H=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
共价键
C—C
C===C
C—H
H—H
键能/(kJ·mol-1)
348
610
413
436
上表数据可以计算出
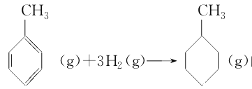 的焓变
的焓变⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25℃,101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④ B.③④⑤ C.④⑤ D.⑥
难度: 困难查看答案及解析
-
下列各组反应中关于能量的比较正确的是( )
①H2(g)+Cl2(g)=2HCl(g)△H1;
H2(g)+
Cl2(g)=HCl (g)△H2;△H1>△H2
②2H2O(l)=2H2(g)+O2(g)△H1; 2Na(s)+2H2O(l)=2NaOH(aq)+H2(g)△H2;△H1>△H2
③CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H1;CH3OH(l)+
O2(g)=CO2(g)+2H2O(g)△H2;△H1<△H2
④t℃时,在一定条件下,将 1mol N2和 3mol H2 分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为 Q1、Q2; Q1<Q2.
A. ①③④ B. ①②④ C. ②③④ D. ①③
难度: 中等查看答案及解析
-
在密闭容器中发生如下反应:mA(g)+nB(g)
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的
,当达到新平衡时,C的浓度为原来的1.5倍,下列说法正确的是( )
A.
B. 平衡向逆反应方向移动
C. A的转化率不变 D. C的体积分数增加
难度: 中等查看答案及解析
-
磷在氧气中燃烧,可能生成P2O3和P2O5,已知单质磷(P)的燃烧热为X kJ/mol,0.1molP在2.24 LO2(标准状况下)燃烧至反应物耗尽时,放出Y kJ 的热量,则下列说法错误的是( )
A. 生成0.025 mol P2O5
B. 生成 P2O3所释放的热量为(Y-0.05X) kJ
C. 2P(s)+3/2O2(g)= P2O3(s) ΔH =-(40Y-2X)kJ·mol-1
D. 生成的 P2O3与 P2O5的质量之比为 1:1
难度: 中等查看答案及解析
-
在1200时,天然气脱硫工艺中会发生下列反应:
H2S(g)+3/2O2(g)=SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)=3/2S2(g)+2H2O(g) △H2
H2S(g)+1/2O2(g)=S(g)+H2O(g) △H3
2S(g)=S2(g) △H4
则△H4的正确表达式为
A. △H4= 2/3(△H1+△H2- 3△H3) B. △H4= 2/3(3△H3-△H1-△H2)
C. △H4= 3/2(△H1+△H2- 3△H3) D. △H4= 3/2(△H1-△H2- 3△H3)
难度: 中等查看答案及解析
-
已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
Fe2O3(s)+
CO(g)=
Fe3O4(s)+CO2(g) △H=-15.73 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.4 kJ·mol-1
则14g CO气体还原足量FeO固体得到固体Fe和CO2气体时,对应的△H为
A.-218 kJ·mol-1 B.-109 kJ·mol-1
C.+218 kJ·mol-1 D.+109 kJ·mol-1
难度: 困难查看答案及解析
-
已知:①CH4(g)+
O2(g)=CO(g)+2H2O(l) △H= -a kJ·mol-1
② 2C(s)+O2(g) =2CO(g) △H=-b kJ·mol-1
③ C(s)+CO2(g)=2CO(g) △H=+c kJ·mol-1
且a、b、c均大于0,则甲烷的燃烧热(△H)为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
反应2NO(g)+2H2(g)═N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,该反应的速率表达式为v=k•cm(NO)•cn(H2)(k、m、n待测),其反应包含下列两步:
①2NO+H2═N2+H2O2(慢)
②H2O2+H2═2H2O(快)
T℃时测得有关实验数据如下:
序号
c(NO)/mol•L-1
c(H2)/mol•L-1
速率/mol•L-1•min-1
Ⅰ
0.0060
0.0010
1.8×10-4
Ⅱ
0.0060
0.0020
3.6×10-4
Ⅲ
0.0010
0.0060
3.0×10-5
Ⅳ
0.0020
0.0060
1.2×10-4
下列说法错误的是
A. 整个反应速度由第①步反应决定
B. 正反应的活化能一定是①<②
C. 该反应速率表达式:v=5000c2(NO)•c(H2)
D. 该反应的热化学方程式为2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-664kJ•mol-1
难度: 困难查看答案及解析
-
已知:2H2(g)+O2(g)===2H2O(l);ΔH=-571.6 kJ·mol-1
CO(g)+
O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1
现有CO、H2和CO2组成的混合气体112.0 L(标准状况)完全燃烧后放出的总热量为851.4 kJ,并生成18 g液态水。则燃烧前混合气体中CO的体积分数为
A.80% B.40% C.60% D.20%
难度: 困难查看答案及解析
-
为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
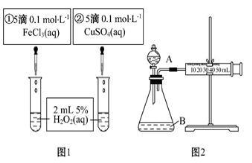
A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间
D.为检查图2装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
难度: 困难查看答案及解析
-
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
A. -1780kJ/mol B. -1220 kJ/mol C. -450 kJ/mol D. +430 kJ/mol
难度: 中等查看答案及解析
-
已知反应:2NO(g)+Br2(g)
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
难度: 中等查看答案及解析
-
已知:(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1
(2)C(s)+O2(g)=CO2(g)△H2
(3)2H2(g)+O2(g)=2H2O(l)△H3
(4)2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l)△H4
(5)2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H5
下列关于上述反应的焓变的判断正确的是
A. △H1>0,△H2<0 B. △H5=2△H2+△H3﹣△H1
C. △H3>0,△H5<0 D. △H4=△H1﹣2△H3
难度: 困难查看答案及解析
-
合成氨反应:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1,在反应过程中,正反应速率的变化如图.下列说法正确的是( )
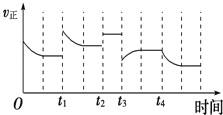
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
难度: 困难查看答案及解析
-
(已知:2 SO2 (g)+O2(g)
2SO3(g) △H = -196.6 KJ·mol- 1), 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。以下叙述错误的是( )
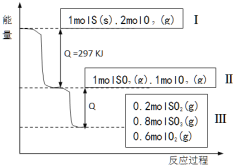
A.表示硫的燃烧热的热化学方程式:S(s)+O2(g)=SO2(g) ΔH=-297 KJ·mol-1
B.由Ⅱ到Ⅲ的过程放出的热量为98.3KJ
C.恒温恒容时,1molSO2和2molO 2 充分反应,放出热量的数值大于78.64KJ
D.将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 2mol
难度: 困难查看答案及解析