-
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为V L的该气体所含有的分子数为X。则表示的是( )
A.V L该气体的质量(以g为单位)
B.1 L该气体中所含的分子数
C.1 mol该气体的体积(以L为单位)
D.1 L该气体的质量(以g为单位)
难度: 简单查看答案及解析
-
在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是( )
A.范德华力、范德华力、范德华力
B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键
D.共价键、共价键、共价键
难度: 简单查看答案及解析
-
某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO、NO
B.Na+、SO、Cl-、S2-
C.NH、Mg2+、SO、NO
D.H+、K+、Cl-、Na+
难度: 简单查看答案及解析
-
工业上生产MnO2和Zn的主要反应有:
①MnO2+ZnS+2H2SO4===MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2OMnO2+Zn+2H2SO4
下列说法不正确的是( )
A.①中MnO2和H2SO4都是氧化剂
B.①中析出16 g S时转移1 mol电子
C.②中MnSO4发生氧化反应
D.硫酸在该生产中可循环利用
难度: 简单查看答案及解析
-
铋(Bi)位于元素周期表中ⅤA族,其价态为+3价较稳定,铋酸钠(NaBiO3)溶液呈无色,取一定量的硫酸锰(MnSO4)溶液依次滴加下列溶液,对应的现象如下表所示:
加入溶液
①适量铋酸钠溶液
②过量的双氧水
③适量KI-淀粉溶液
实验现象
溶液呈紫红色
紫红色消失,产生气泡
溶液变成蓝色
关于NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.I2、H2O2、KMnO4、NaBiO3
B.H2O2、I2、NaBiO3、KMnO4
C.NaBiO3、KMnO4、H2O2、I2
D.KMnO4、NaBiO3、I2、H2O2
难度: 困难查看答案及解析
-
CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:
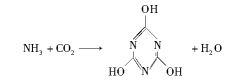
下列有关三聚氰酸的说法正确的是( )
A.分子式为C3H6N3O3
B.分子中既含极性键,又含非极性键
C.属于共价化合物
D.生成该物质的上述反应为中和反应
难度: 中等查看答案及解析
-
根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
选项
事实
推测
A
12Mg与水反应缓慢,20Ca与水反应较快
56Ba(第ⅡA族)与水反应会更快
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素的单质都可作半导体材料
C
HCl在1 500 ℃时分解,HI在230 ℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时反应,S与H2加热能反应
P与H2在高温时能反应
难度: 中等查看答案及解析
-
原子序数依次增大的X、Y、Z、M、W为五种短周期元素。已知Y与Z、M与W分别同周期,X与M同主族;X、Z、M的质子数之和等于Y、W的质子数之和;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76 g·L-1;Y、M、W的最高价氧化物的水化物,两两间都能发生反应。下列说法不正确的是( )
A. 由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同
B. 含有W阳离子的某种盐,可用作净水剂
C. M的单质可保存于煤油中
D. 由X、Y、Z三种元素形成的某种化合物的水溶液,可能呈碱性或酸性
难度: 困难查看答案及解析
-
铝材经脱脂后进行碱洗以除去氧化膜,将碱洗后的溶液中的铝以沉淀形式回收,最好加入下列试剂( )
A.氨水 B.CO2
C.NaOH D.HNO3
难度: 简单查看答案及解析
-
世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成生石灰;②在海水中加入生石灰,过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中加热晶体;⑤电解上述所得盐(熔融条件下)。下列说法正确的是( )
A.向洗涤液中滴加氯化钙溶液可检验沉淀是否洗涤干净
B.上述变化过程中包括了分解、化合、复分解、置换等四种反应类型
C.步骤④在氯化氢热气流中加热晶体的目的是为了防止氯化镁水解
D.步骤⑤也可以采用电解该盐水溶液的方法
难度: 中等查看答案及解析
-
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O+O2+aOH-===Y+S4O+2H2O,下列有关说法不正确的是( )
A.a=4
B.Y的化学式为Fe2O3
C.S2O是还原剂
D.每32 g O2参加反应,转移电子的物质的量为4 mol
难度: 中等查看答案及解析
-
甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各向其中加入1 mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是( )
A.甲中沉淀一定比乙中的多
B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少
D.实验过程中甲中和乙中的现象始终保持一致
难度: 中等查看答案及解析
-
将1.12 g铁粉加入25 mL 2 mol/L的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变
B.往溶液中滴入无色KSCN溶液,溶液变红色
C. Fe2+和Fe3+物质的量之比为51
D.氧化产物和还原产物的物质的量之比为25
难度: 困难查看答案及解析
-
将铝粉与Fe3O4粉末配制成铝热剂,分成三等份。
①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;
②一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为V2;
③一份直接放入足量的盐酸中,充分反应后放出气体在标准状况下的体积为V3。
下列说法正确的是( )
A.V1=V3>V2 B.V2>V1=V3
C.V1=V2>V3 D.V1>V3>V2
难度: 困难查看答案及解析
-
向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙;向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )
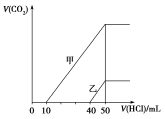
A.原NaOH溶液的物质的量浓度为0.5 mol·L-1
B.当0<V(HCl)<10 mL时,甲溶液中发生反应的离子方程式为:OH-+H+===H2O
C.乙溶液中含有的溶质是NaOH、NaHCO3
D.乙溶液中滴加盐酸后产生CO2体积的最大值为112 mL(标准状况)
难度: 简单查看答案及解析
-
氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可生成CuH。下列叙述中错误的是( )
A.“某物质”具有还原性
B.CuH与盐酸反应可能产生H2
C.CuH与足量稀硝酸反应:CuH+3H++NO===Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2===CuCl+HCl
难度: 简单查看答案及解析
-
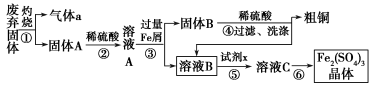
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是( )
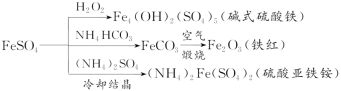
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
难度: 中等查看答案及解析
-
向一定量的Cu、Fe2O3的混合物中加入300 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
A.2.4 g B.4.8 g
C.6.4 g D.1.6 g
难度: 简单查看答案及解析
-
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-;且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为( )
A.3∶2∶1 B.2∶4∶1
C.2∶3∶1 D.4∶2∶1
难度: 简单查看答案及解析
-
部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是( )
A.滤液A中的阳离子为Fe3+、Fe2+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896
难度: 简单查看答案及解析




 。
。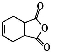 )是合成抗病毒药物阿昔洛韦的中间体。参照上述合成路线,写出以1,3—丁二烯为原料制备H的合成路线流程图(无机试剂任用):
)是合成抗病毒药物阿昔洛韦的中间体。参照上述合成路线,写出以1,3—丁二烯为原料制备H的合成路线流程图(无机试剂任用):