-
下列有关电离和水解的说法正确的是( )
A. 醋酸溶液中加入冰醋酸,电离平衡正向移动,醋酸的电离程度增大
B. 升温,醋酸钠溶液的水解程度增大,c(OH-)增大,pH也增大
C. 等体积等浓度的醋酸和氨水混合后,溶液显中性,则水电离出的c(H+)为10-7 mol/L
D. 醋酸溶液中加水稀释,溶液中c(H+)/c(CH3COO-)增大,n(H+)减小。
难度: 困难查看答案及解析
-
下列说法正确的是
A. 反应物的热效应与是否使用催化剂无关
B. 4NO2(g)+O2(g)=2N2O5 (g)的过程属于熵增加过程
C. 由C(石墨)= C(金刚石)△H﹥0,可知金刚石比石墨稳定
D. 对任何化学反应来说,反应速率越大,反应现象就越明显
难度: 简单查看答案及解析
-
已知甲烷的燃烧热为890.3 kJ•mol-1。氢气的燃烧热为285.8 kJ•mol-1。现有9 mol的甲烷和氢气的混合气体,完全燃烧后放出热量7408.2 kJ,则该混合气体中甲烷和氢气的物质的量比为( )
A. 1∶8 B. 8∶1 C. 4∶17 D. 17∶4
难度: 简单查看答案及解析
-
已知乙醇、石墨和氢气的燃烧热分别为a、b、c(均为正值,单位均为kJ·mol-1)。则反应2C(s,石墨)+2H2(g)+H2O(l)==C2H5OH(l)的焓变为( )
A. (2b+2c-a) kJ·mol-1 B. (b+c-a) kJ·mol-1
C. (a-2b-2c) kJ·mol-1 D. (a-2b-c) kJ·mol-1
难度: 简单查看答案及解析
-
T℃时,对于可逆反应:A(g)+B(g)
2C(g) +D(g) △H>0。 下列各图中正确的是
A.
 B.
B. 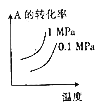 C.
C.  D.
D. 
难度: 中等查看答案及解析
-
在恒容密闭容器中通入X并发生反应:2X(g)
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
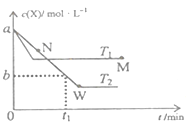
A. M点的正反应速率υ正小于N点的逆反应速率υ逆
B. T2下,在0~t1时间内,υ(Y)=
mol/(L·min)
C. M点时再加入一定量X,平衡后X的转化率减小
D. 该反应进行到M点放出的热量小于进行到W点放出的热量
难度: 中等查看答案及解析
-
拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g)
2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
A. H-H比N≡N更牢固
B. N≡N键能约为946 kJ/mol
C. 合成氨反应选择适当的催化剂是为了提高H2的转化率
D. 0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
难度: 中等查看答案及解析
-
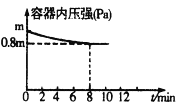
在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是( )

A. 该温度下此反应的平衡常数K=3.2
B. 从反应开始到t1时的平均反应速率v(X)=
mol·L-1·min-1
C. 欲提高平衡体系中Y的百分含量,可加入一定量的X
D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少
难度: 中等查看答案及解析
-
一定温度下(T2> Tl),在3个体积均为2.0 L的恒容密闭容器中反应 2NO(g)+ Cl2(g) = 2ClNO(g)(正反应放热)达到平衡,下列说法正确的是

A. 达到平衡时,容器I与容器II中的总压强之比为1:2
B. 达到平衡时,容器III中ClNO的转化率小于80%
C. 达到平衡时,容器II中c(ClNO(/ c(NO)比容器I中的大
D. 若温度为Tl,起始时向同体积恒容密闭容器中充入0.20 mol NO(g)、0.2 mol Cl2(g)和0.20 mol ClNO(g),则该反应向正反应方向进行
难度: 困难查看答案及解析
-
常温下,将一定量的氨基甲酸铵置于密闭真空容器中(固体体积忽略不计)发生反应:H2NCOONH4(s)
2NH3(g)+CO2(g)△H,达到平衡时测得c(CO2)=amol·L-1。温度不变,达到平衡后压缩容器体积至原来的一半,达到新平衡时测得c(NH3)=xmol·L-1。下列说法正确的是( )
A. 混合气体的平均相对分子质量不再变化时表明达到平衡状态
B. 达到新平衡时,△H为原来的2倍
C. 上述反应达到新平衡状态时x=2a
D. 上述反应体系中,压缩容器体积过程中n(H2NCOONH4)不变
难度: 困难查看答案及解析
-
在某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g)
C(g)+D(g),5min后达到平衡,各物质的平衡浓度的关系为:ca(A)•c(B)=c(C)•c(D)。若在温度不变的情况下将容器的体积扩大为原来的8倍,A的转化率不发生变化,则B的转化率为( )
A. 60% B. 40% C. 50% D. 无法确定
难度: 中等查看答案及解析
-
下列关于电解质溶液的叙述正确的是( )
A. 室温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
B. 将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D. 室温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
难度: 中等查看答案及解析
-
室温下,有2种溶液0.01 mol·L-1 NH3·H2O和0.01 mol·L-1 NH4Cl,下列操作可以使2种溶液中c(NH4+)都增大的是( )
A. 通入少量HCl气体 B. 加入少量H2O
C. 加入少量NaOH固体 D. 升高温度
难度: 中等查看答案及解析
-
对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
A. KAl(SO4)2溶液加热 B. Na2CO3溶液加热
C. 氨水中加入少量NH4Cl固体 D. NH4NO3溶液中加入少量NaNO3固体
难度: 中等查看答案及解析
-
浓度均为0.1mol/L的以下几种溶液:①NH4Cl;②NH3·H2O;③NH4HSO4;④(NH4)2SO4;⑤NH4HCO3;⑥(NH4)2CO3;⑦(NH4)2Fe(SO4)2,NH4+浓度由大到小的顺序是
A. ④⑥⑦②③①⑤ B. ②⑤①③⑥④⑦
C. ⑥④⑦①⑤②③ D. ⑦④⑥③①⑤②
难度: 困难查看答案及解析
-
下列说法不正确的是
A. 铵态氮肥和草木灰(含K2CO3)可混合施用 B. 明矾可做净水剂
C. 配制氯化铁溶液,常将氯化铁先溶于盐酸 D. 常将纯碱溶于热水中清洗油污
难度: 中等查看答案及解析
-
下列实验操作所得的现象及结论均正确的是( )
选项
实验操作
现象及结论
A
将AlCl3溶液加热蒸干
得到白色固体,成分为纯净的AlCl3
B
将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液
有白色沉淀产生,则Na2SO3己变质
C
用量筒量取一定体积的浓硫酸时,仰视读数
所量取的浓硫酸体积偏大
D
向FeI2溶液中通入少量Cl2
溶液变黄,则Cl2的氧化性强于Fe3+
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列水解反应的应用,不正确的是
A. 热的纯碱溶液清洗油污:
B. 明矾净水:
C. 用TiCl4制备Ti02:
D. 配制氯化亚锡溶液时应加入氢氧化钠:
难度: 中等查看答案及解析
-
由水电离产生的c(H+)为1×10-12 mol/L的溶液中,能大量共存的离子组是
A. K+、Cl-、NH4+、HS- B. K+、Fe3+、I-、SO42-
C. Na+、Cl-、NO3- 、SO42- D. Na+、Ca2+、Cl-、HCO3-
难度: 中等查看答案及解析
-
H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为:I2+2Na2S2O32NaI+Na2S4O6,下列说法合理的是( )

A. 该滴定可选用如图所示装置
B. 该滴定可用甲基橙作指示剂
C. Na2S2O3是该反应的还原剂
D. 该反应中每消耗2 mol Na2S2O3,电子转移数为4 mol
难度: 中等查看答案及解析
-
25℃时,在一定体积pH=12的NaOH溶液中,加入一定体积0.01 mol·L-1的NaHSO4溶液,此时混合溶液的pH=11。若反应后溶液的体积等于NaOH溶液与NaHSO4溶液的体积之和,则NaOH溶液与NaHSO4溶液的体积比是( )
A. 1∶9 B. 10∶1 C. 11∶9 D. 1∶2
难度: 中等查看答案及解析
-
氢硫酸中存在电离平衡:H2S
H++HS-和HS-
H++S2-。已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是
A. 加水,会使平衡向右移动,溶液中氢离子浓度增大
B. 加入20ml浓度为0.1mol/L NaOH溶液,则c(Na+)=c(HS-)+c(H2S)+2c(S2-)
C. 通入过量SO2气体,平衡向左移动,溶液pH值始终增大
D. 加入10ml浓度为0.1mol/L NaOH溶液,则c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 1L浓度为0.1mol/L的NH4Cl溶液阳离子数目多于氯离子数目
B. 比较浓度均为0.1mol·L-1的HI和醋酸溶液的导电能力可判断HI为强酸
C. 常温下,pH=3的醋酸溶液水加稀释1000倍后溶液的pH<6
D. 常温下,同体积的pH=9的NaClO溶液和pH=5的NH4Cl溶液水电离的OH-数相同
难度: 中等查看答案及解析
-
25℃时,纯水中存在的平衡:H2O
H+ + OH-,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 加入稀盐酸,平衡逆向移动,c(H+)降低
C. 加入氢氧化钠溶液,平衡逆向移动,Kw变小
D. 加入少量固体CH3COONa,平衡正向移动,c(H+)降低
难度: 简单查看答案及解析
-
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是
A. 酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B. 锥形瓶用蒸馏水洗净,必须干燥后才能加入一定体积未知浓度的NaOH溶液
C. 滴定时,没有排出滴定管中的气泡
D. 读数时视线与滴定管内液体凹液面最低处保持水平
难度: 中等查看答案及解析
-
对于可逆反应:2SO2(g)+O2(g)
2SO3(g),下列措施能减少反应物活化分子百分数、降低反应速率的是
A. 增大压强 B. 移除一部分SO3 C. 使用催化剂 D. 降低温度
难度: 中等查看答案及解析
-
下列各组物质全部是弱电解质的是( )
A. H2SO3、Ba(OH)2、BaSO4 B. Cu(OH)2、CH3COOH、C2H5OH、CH3COONa
C. SO2、H2S、CO2 D. H2O、NH3·H2O、H3PO4、HF
难度: 简单查看答案及解析
-
下列说法正确的是
A. 生成物的总能量大于反应物的总能量时,ΔH<0
B. 在其他条件不变的情况下,使用催化剂可以改变反应的焓变
C. ΔH<0、ΔS >0的反应在低温时不能自发进行
D. 一个化学反应的ΔH只与反应体系的始态和终态有关,而与反应的途径无关
难度: 简单查看答案及解析
-
常温下,将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为
A. 1014-a-2b B. 10 a+b-14 C. 10a-2b D. 10a-2b+14
难度: 中等查看答案及解析
-
常温时,下列各溶液中,物质的量浓度关系错误的是( )
A. 在0.1 mol·L-1NaClO溶液中,c(Na+)=c(HClO)+c(ClO-)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C. 10 mL pH=2的HCl溶液与10 mL 0.01 mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的: c(Cl-)+c(OH-)=c(Ba2+)+c(H+)
D. 10 mL 0.5 mol/L Na2CO3溶液中慢慢滴入10 mL 0.5 mol/L盐酸后的溶液:c(CO32-)+c(OH-)=c(H2CO3)+c(H+)
难度: 困难查看答案及解析