-
氮及其化合物在工农业生产、生活中有着重要作用。
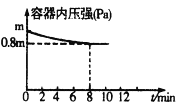
(1)在T℃时,将0.6molH2和0.4molN2置于容积为2 L的密闭容器中(压强为mPa)发生反应:3H2+N2 2NH3 △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为____mol·L-1·min-1。
2NH3 △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为____mol·L-1·min-1。
(2)仍在T℃时,将0.6molH2和0.4molN2置于一容积可变的密闭容 器中。
①下列各项能说明该反应已达到平衡状态的是_______(填序号)。
a.容器内N2、H2、NH3的浓度之比为l:3:2
b.3v正(N2)=v逆(H2)
c.3v正(H2)=2v逆(NH3)
d.混合气体的密度保持不变
e.容器中气体的平均相对分子质量不随时间而变化
②该条件下达到平衡时NH3的体积分数与题(1)条件下NH3的体积分数相比 ________ (填“变大”“变小”或“不变”)。
(3)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。氨气能将氮氧化物还原为氮气和水,其反应机理为:
2NH3(g)+5NO2(g)=7NO(g)+3H2O(g)  H=-akJ·mol-1
H=-akJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)  H=-bkJ·mol-1
H=-bkJ·mol-1
则NH3直接将NO2还原为N2的热化学方程式为:_______________。
若标准状况下NO与NO2混合气体40.32L被足量氨水完全吸收,产生标准状况下氮气42.56L。该混合气体中NO与NO2的体积之比为________。
-
氯及其化合物在工农业生产和人类生活中有着重要的作用。回答下列问题:
(1)25℃时将氯气溶于水形成“氯气-氯水”体系,该体系存在多个含氯元素的平衡关系,其中之一为:Cl2(溶液)+H2O HClO+H++Cl-,体系中Cl2(溶液)、HClO和ClO-三者的物质的量分数(α)随pH(酸碱度)变化的关系如图所示。已知HClO的杀菌能力比ClO-强,用氯气处理饮用水时,杀菌效果最强的pH范围为__(填字母)。
HClO+H++Cl-,体系中Cl2(溶液)、HClO和ClO-三者的物质的量分数(α)随pH(酸碱度)变化的关系如图所示。已知HClO的杀菌能力比ClO-强,用氯气处理饮用水时,杀菌效果最强的pH范围为__(填字母)。
A.0~2 B.2~4.7 C.4.7~7.5 D.7.5~10

(2)写出次氯酸光照分解的化学方程式___,如果在家中直接使用自来水养金鱼,除去其中残留的次氯酸可采取的简易措施为__。
(3)NaClO、NaClO2、ClO2等含氯化合物都是常见的消毒剂,这是因为它们都具有强氧化性。
①写出工业上用氯气和NaOH溶液生产消毒剂NaClO的化学方程式___;
②84消毒液(主要成分是NaClO)与洁厕灵(主要成分是盐酸)混在一起使用会产生有毒气体Cl2,其反应的离子方程式为__;
③NaClO2中Cl元素化合价为__;
④ClO2的杀菌效果比Cl2好,等物质的量的ClO2杀菌效果是Cl2的__倍(杀菌效果与单位物质的量的氧化剂得电子的物质的量有关,ClO2与Cl2消毒杀菌后均被还原为Cl-)。
-
氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。下列叙述与氮元素的循环无关的是( )
A. 工业合成氨的过程是固氮的过程
B. 自然界中,氨是动物体特别是蛋白质腐败后的产物
C. 为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气
D. 在电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)如图1是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质均为气态),请写出NO2和CO反应的热化学方程式 。
(2)在0.5L的密闭容器中,充入一定量的氮气和氢气进行反应,三种气体的物质的量随时间的变化曲线如图2所示。则Y是 ,2min内N2的反应速率υ(N2)= 。
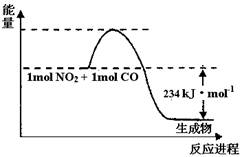
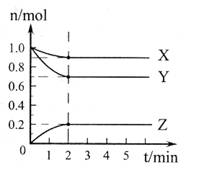
图1 图2
(3)硝酸工业在国民经济、国防工业和航天事业中占有重要地位。随着化学纤维、近代有机合成、火箭、导弹等工业的迅速发展,需要使用大量的硝酸。
①工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸。第一步反应为氨在催化剂作用下与氧气发生反应生成NO,写出反应化学方程式 。
②铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。反应中还原产物是 ,0.6mol Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下气体体积为 L。
-
氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。下列叙述与氮元素的循环无关的是
A. 工业合成氨的过程是固氮的过程
B. 自然界中,氨是动物体特别是蛋白质腐败后的产物
C. 为防止粮食、罐头、水果等食品腐烂,常用氮气作保护气
D. 在电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收
-
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
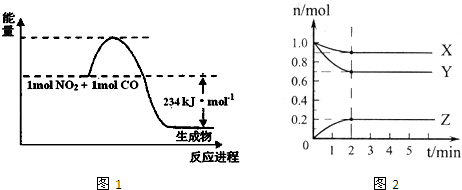
(1)如图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(图中涉及物质均为气态),请写出NO2和CO反应的热化学方程式________.
(2)在0.5L的密闭容器中,充入一定量的氮气和氢气进行反应,三种气体的物质的量随时间的变化曲线如图2所示.则Y是________,2min内N2的反应速率υ(N2)=________.
(3)硝酸工业在国民经济、国防工业和航天事业中占有重要地位.随着化学纤维、近代有机合成、火箭、导弹等工业的迅速发展,需要使用大量的硝酸.
①工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸.第一步反应为氨在催化剂作用下与氧气发生反应生成NO,写出反应化学方程式________.
②铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平).反应中还原产物是________,0.6mol Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下气体体积为________L.
-
氮元素在地球上含量丰富,氮及其化合物在工农业生产、生活中有着重要作用。下列叙述与氮元素的循环无关的是
A.工业合成氨的过程是固氮的过程
B.自然界中,氨是动物体特别是蛋白质腐败后的产物
C.为防止粮食、罐头、水果等食品腐烂,常用氮气作保护气
D.电闪雷鸣的雨天,N2与O2会发生反应并最终转化为硝酸盐被植物吸收
-
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,下图是N2(g)和H2(g)反应生成1mo1NH3(g)过程中能量变化示意图,

请写出N2和H2反应的热化学方程式:_____________________________;
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能______kJ•mol-1
(3)已知100ml lmol/L的氢氧化钠溶液与适量硫酸溶液完全反应放出5.73kJ的热量,请写出表示中和热的热化学方程式________________________________;
(4)已知1克氢气完全燃烧生成液态水时放出akJ的热量,请写出表示氢气燃烧热的热化学方程式____________________________________________。
-
氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_________________________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。该图示的总反应为_________________________。
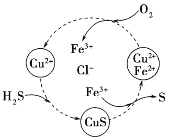
(3)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平。
___Al+___NO3-+___ =___AlO2-+___N2↑+___H2O
-
氨气是一种重要化合物,在工农业生产、生活中有着重要应用。
(1) 实验室制备NH3,下列方法中可以选用的是_______________。
A.固态氯化铵与熟石灰混合加热 B.固态氯化铵加热分解
C.碱石灰中滴加浓氨水 D.氯化铵溶液与氢氧化钠溶液共热
(2) “氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收所得气体制取硝酸(固定装置略去):
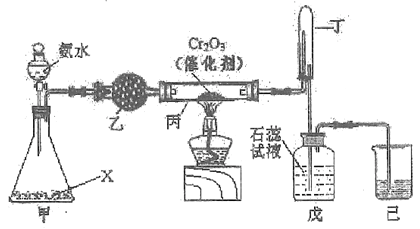
①盛装氨水仪器的名称是________。甲装置不需要加热即能同时产生氨气和氧气,则锥形瓶内固体X的化学式为____________。
②乙装置中药品的名称是_________。写出受热时丙装置发生反应的化学方程式________。
③当戊中观察到______现象,则说明戊中制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,并没有观察到此现象,请分析实验失败的可能原因________,如何改进装置_________。
(3) 若将氨气和氯气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出该反应的化学方程式_____________。
2NH3 △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为____mol·L-1·min-1。

H=-akJ·mol-1
H=-bkJ·mol-1






