-
2017年我国自主产权“全球首套煤基乙醇工业化项目”投产成功。“煤基乙醇”就是以煤为原料制备乙醇。乙醇能做燃料,可以添加到汽油中。下列说法错误的是
A. 煤制乙醇,有利于保护环境,实现能源充分利用
B. 煤制乙醇可缓解靠发酵产生乙醇导致的“与人类争粮”的局面
C. 等物质的量的乙醇、汽油完全燃烧,乙醇放出的热量多
D. 乙醇是世界公认的优良汽油添加剂,可有效改善汽油品质
难度: 中等查看答案及解析
-
下列“化学知识原理”对“实际应用”的解释说明错误的是
选项
实际应用
化学知识原理
A
选用金属锂做锂电池的负极
锂轻且在空气中稳定
B
工业采用高压(20-50MPa)合成NH3
应用勒夏特列原理
C
施加石膏降低盐碱地(含Na2CO3)的碱性
CaCO3溶度积小于CaSO4
D
在船身上装锌块来避免船体遭受腐蚀
Zn比Fe活泼
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
环扁桃酸酯是治疗心脑血管疾病的有效药物。苯乙酸是合成环扁桃酸酯的重要中间体,其结构简式如下,下列关于苯乙酸的说法错误的是
A. 与苯甲酸互为同系物
B. 有6种含酯基的芳香化合物与其互为同分异构体
C. 能发生取代反应和加成反应
D. 与CH3CH2OH所生成酯的分子式为C10H14O2
难度: 中等查看答案及解析
-
下列操作不能实现实验目的的是
实验目的
实验操作
A
制取乙酸乙酯,提高其效率
加热,将乙酸乙酯蒸出
B
比较Mg、Al的金属性
分别将打磨过的镁带、铝片放入沸水中
C
羟基影响与其相连的苯环活性
分别将饱和溴水滴入苯和苯酚溶液中
D
制备Fe2O3固体
将H2O(g)通入装有铁粉的试管,加热
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增加,W-与Ne具有相同的电子曾结构,X的族序数等于周期数,Y与Z最外层电子数之和为10。下列说法不正确的是
A. 原子半径:X>Y>Z>W
B. 单质沸点:W>Y>Z
C. 简单氢化物的还原性:Y>Z>W
D. W、X、Z的离子均能促进水的电离
难度: 中等查看答案及解析
-
利用图所示的装置可将CO2转化为燃料甲醇,下列说法正确的是
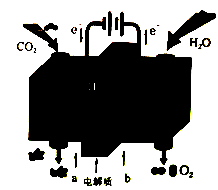
A. b极发生还原反应
B. a极的电极反应:CH3OH+H2O-6e-=CO2+6H+
C. 总反应方程式为:2CO2+4H2O
2CH3OH+3O2
D. 该装置将化学能转变为电能
难度: 困难查看答案及解析
-
一种测定水样中溴离子的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液。
②加入V1mL c1mol·L-1 AgNO3溶液(过量),充分摇匀。
③用c2mol·L-1KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL 。
(已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-= AgSCN(白色)↓,Ksp(AgSCN)=1×10-12)下列说法不正确的是
A. 滴定终点时,溶液变为红色
B. 该滴定法需在碱性条件下进行
C. AgBr(s)+SCN-
AgSCN(s)+Br-(aq)的平衡常数K=0.77
D. 该水样中溴离子浓度为:c(Br-)=(c1V1-c2V2)/25.00mol/L
难度: 困难查看答案及解析
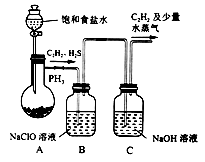
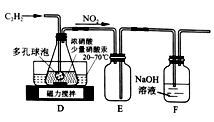

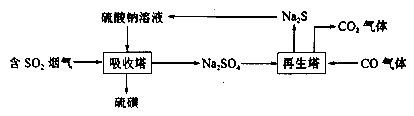
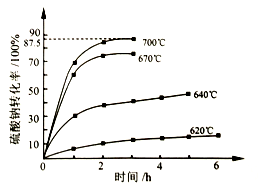

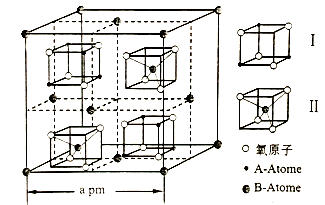
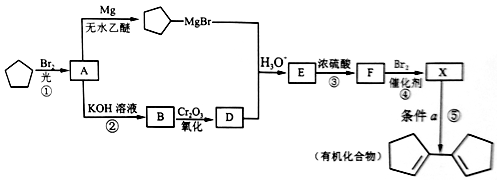
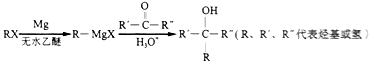
 ,写出合成路线:_________。
,写出合成路线:_________。