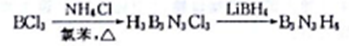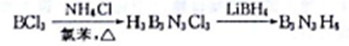-
铁、铁合金及其化合物用途非常广泛。回答下列问题:
(1)基态铁原子价电子排布式为______,元素Mn与Fe的第三电离能分别为:
IMn=3248 KJ/mol、IFe=2957Kj/mol,IMn>IFe的原因是__________。
(2)铁能形成[Fe(Bipy)2C12]ClO4等多种配合物(Bipy结构如右图)。

①该配合物中中心原子的化合价为________;与中心原子形成配位键的原子是________。
②ClO4-的空间构型为_______,与其互为等电子体的一种非极性分子是_______(举1例)。
③1 mol Bipy中所含σ键______mol;碳原子杂化方式是_______;Bipy 的沸点为260℃,结构类似且相对分子质量接近的环戊二烯( )的沸点为42.5℃,前者较大的原因是_____。
)的沸点为42.5℃,前者较大的原因是_____。
(3)Fe3O4的晶胞结构图示如下(8个小立方体内各含有一个I 或Ⅱ):
①可表示二价Fe的是图中_____原子(填“A” 或“B”)。
②已知Fe3O4的熔点为1594.5℃,FeCl3的熔点306℃,两者熔点相差较大的原因是______。
③四氧化三铁晶体晶胞边长为a pm,则其密度为_____g·cm-3。(列出表达式即可)。
-
含铬化合物及铬合金用途非常广泛。回答下列问题:
⑴基态Cr原子价电子排布式为___;第三电离能I3(Cr)=2987kJ·mol-1,I3(Mn)=3248kJ·mol-1,I3(Cr)<I3(Mn),其原因是___。
⑵Cr-Ni-Si是具有八边形相的准晶体,准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___法区分晶体、准晶体和非晶体。
⑶已知反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+6NO2↑+16K2SO4+55H2O。
①根据价层电子对互斥理论,SO2、CO2、H2O的气态分子中,中心原子价层电子对数目依次为___、___、___。
②写出一种与SCN-互为等电子体的分子:___(填化学式)。
③KSCN可制备配合物[Cr(NH3)6][Cr(SCN)6],该配合物中铬元素的化合价为___,两个配体NH3、SCN-中,中心原子杂化类型依次为___、___。
⑷一种具有萤石结构的CrO2的晶胞结构如图所示,晶胞参数为apm。则两个氧原子间的距离为___pm,Cr-O键的键长为___pm;设NA为阿伏加德罗常数的值,则CrO2的密度为___g·cm-3(列出计算式)。
-
氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:
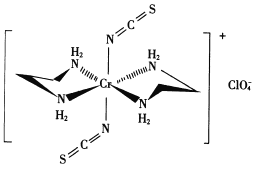
①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
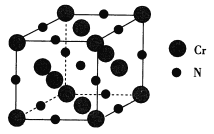
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.
-
氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:
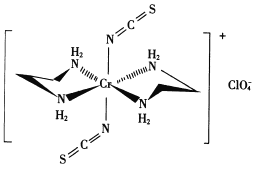
①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
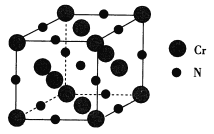
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.
-
氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:
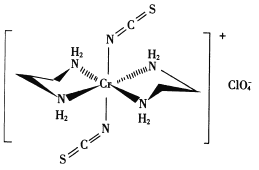
①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.

-
硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:
(1)VB2是一种导电陶瓷材料,基态钒原子的价电子排布图为___________
(2)B、C、N、O四种元素第一电离能由小到大的顺序为_______________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示:
| 卤化物 | BF3 | BCl3 | BBr3 | BI3 |
| 沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是_________________。
②用BF3分子结构解释反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生的原因:_________________。
③制备环硼氨烷的方法如下:

BCl3、LiBH4中硼原子的杂化轨道类型依次为_________________;与B3N3H6互为等电子体的分子的结构简式为___________________。
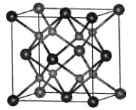
(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。
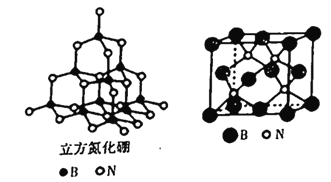
①晶胞中每个氮原子周围与其最近且等距离的硼原子有_____个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化硼的晶胞中, B原子的坐标参数分别有:B(0,0,0),B( ,0,
,0,  );B(0,
);B(0,  ,
,  )等,则距离上述三个B原子最近且等距离的N原子的坐标参数为___________________。
)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为___________________。
③已知氮化硼晶胞边长为apm,则氮化硼晶体的密度为____g·cm-3(设NA为阿伏加德罗常数值,只要求列算式)。
-
硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:
(1) VB2是一种导电陶瓷材料,基态钒原子的价电子排布图为_______。
(2)B、C、N三种元素第一电离能由小到大的顺序为________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
| BF3 | BCl3 | BBr3 | BI3 |
| 沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是__________________。
②用BF3分子结构解释反应BF3(g)+NH4F(s)==NH4[BF4] (s)能够发生的原因:____________。
制备环硼氨烷的方法如下:
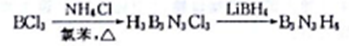
BCl3、LiBH4中硼原子的杂化轨道类型依次为_________;与B3N3H6互为等电子体的分子的结构简式为________________。
(4)立方氮化硼的熔点为3000℃,其晶胞结构如图所示,晶胞参数a=361.5pm。
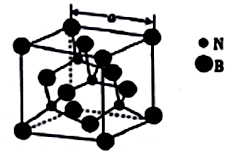
①立方氮化硼的晶体类型为_______________。
②紧邻的两个硼原子间的距离为_______(列出计算式即可) pm。
③立方氮化硼的密度为_____(列出计算式即可)g•㎝-3。
-
硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:
(1) VB2是一种导电陶瓷材料,基态钒原子的价电子排布图为_______。
(2)B、C、N三种元素第一电离能由小到大的顺序为________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
| BF3 | BCl3 | BBr3 | BI3 |
| 沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是__________________。
②用BF3分子结构解释反应BF3(g)+NH4F(s)==NH4[BF4] (s)能够发生的原因:____________。
制备环硼氨烷的方法如下:
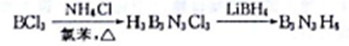
BCl3、LiBH4中硼原子的杂化轨道类型依次为_________;与B3N3H6互为等电子体的分子的结构简式为________________。
(4)立方氮化硼的熔点为3000℃,其晶胞结构如图所示,晶胞参数a=361.5pm。
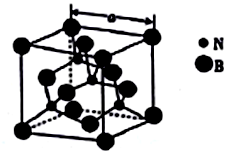
①立方氮化硼的晶体类型为_______________。
②紧邻的两个硼原子间的距离为_______(列出计算式即可) pm。
③立方氮化硼的密度为_____(列出计算式即可)g•㎝-3。
-
氮的化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列相关问题:
(1)基态氮原子的价层电子排布式为__________________,碳、氮、氧元素的第一电离能由小到大的顺序为_________________(用元素符号表示)。
(2)NH4Cl中氮原子的杂化方式为____________,与NH4+互为等电子体的一种非极性分子的化学式为_______________。
(3)NH4Cl受热易分解产生氨气,向CuSO4溶液中通入氨气至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,该溶液中存在的配离子的结构式为___________________。
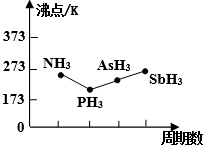
(4)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因__________________________________________________。
(5)第VA族气态氢化物沸点如下图所示,试解释沸点PH3<NH3,PH3<AsH3<SbH3的原因____________________________________________________________________。
(6)氮化镓是具有重要应用价值的半导体,其部分晶体结构如下图所示,每个晶胞中Ga原子个数为____个,若晶胞底边长为a nm,高为c nm,则氮化镓的晶体密度为___________g/cm3
(用含a、c的代数式表示,阿伏加德罗常数用NA表示)。

-
(化学选修3——物质结构与性质)硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道表达式为____,第四电离能I4(Co)<I4(Fe),其原因是____;Co与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是____。
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的空间构型是____,中心原子杂化方式是____,与其互为等电子体的分子是____(任写1种)。
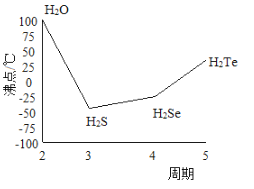
(3) K 和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是____。
(4)S 与O、Se、Te位于同一主族,它们的氢化物的沸点如下左图所示,沸点按图像所示变为的原因是____。
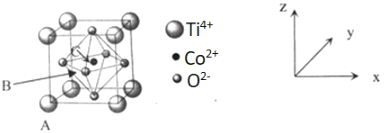
(5)钴的一种化合物晶胞结构如上图所示。
①已知A点的原子坐标参数为(0,0,0),C点为(1/2,1/2,1/2),则B点的原子坐标参数为____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为____g·cm-3 (列出计算表达式即可)。

)的沸点为42.5℃,前者较大的原因是_____。