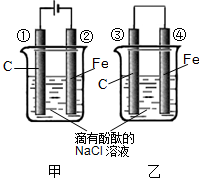
-
下列反应属于吸热反应的是 ( )
A.炭燃烧生成一氧化碳 B.中和反应
C.锌粒与稀H2SO4反应制取H2 D.Ba(OH)2·8H2O与NH4Cl反应
难度: 简单查看答案及解析
-
银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH- ;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是( )
A.锌为正极,Ag2O为负极; B.锌为阳极,Ag2O为阴极;
C.原电池工作时,负极区pH减小; D.原电池工作时,负极区pH增大;
难度: 简单查看答案及解析
-
在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用( )
A.NaOH B.HC1 C.NaCl D.CuSO4
难度: 简单查看答案及解析
-
硫代硫酸钠与酸反应的实验中,观察到的最明显的实验现象是
A.产生大量气泡 B.溶液沸腾是有大量的热量产生
C.出现淡黄色浑浊 D.出现白色浑浊
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.在101kPa时1mol物质燃烧时的反应热叫做该物质的标准燃烧热
B.热化学方程式中,各物质前的化学计量数不表示分子个数
C.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应。
D.化学反应的自发性仅由反应的焓变或熵变决定
难度: 简单查看答案及解析
-
诺贝尔奖委员会将2007年度诺贝尔化学奖授予致力于研究氨的合成与催化剂表面积大小关系的德国科学家格哈德•埃特尔,以表彰他在“固体表面化学过程”研究中作出的贡献。下列说法中正确的是
A.增大催化剂的表面积,能增大氮气的转化率
B.增大催化剂的表面积,能同时、同程度增大合成氨的正、逆反应速率
C.工业合成氨采用高压,且压强越高越有利于提高经济效益
D.当断裂3mol H-H键的同时断裂2mol N-H键时,达到了化学平衡状态
难度: 简单查看答案及解析
-
1gH2完全燃烧生成液态水放出142.9KJ热量,下列反应的热化学方程式正确的是
A、H2 + O2=2H2O △H= -571.6KJ/mol
B、H2 (g)+1/2O2(g)= H2O (l) △H= -142.9KJ/mol
C、H2 (g)+1/2O2(g)= H2O (l) △H= -285.8KJ/mol
D、2H2 (g) + O2(g) = 2H2O (g) △H= -571.6KJ/mol
难度: 简单查看答案及解析
-
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
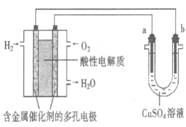
A.若a极是铜,b极为铁时,当电池消耗1.6gO2,b极上析出6.4g铜
B.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
C.若a极是粗铜,b极是纯铜时,a极减少的质量等于b极上析出铜的质量。
D.若a、b两极均是石墨时,b极反应为4OH- - 4e-=O2↑ + 2H2O
难度: 简单查看答案及解析
-
如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是
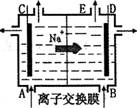
A. 从E口逸出的气体是H2
B. 从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,同时产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42一等离子,精制时先加Na2CO3溶液
难度: 简单查看答案及解析
-
某反应A + B = C + D 在低温下能自发进行,在高温下不能自发进行,对该反应过程△H、△S的判断正确的是
A.△H <0 △S >0 B.△H >0 △S >0 C.△H <0 △S <0 D.△H >0 △S <0
难度: 简单查看答案及解析
-
把下列四种Na2S2O3溶液分别加入四个盛有10mL 2mol/L硫酸的锥形瓶中,均加水稀释到50mL,其中反应最快的是
A.10℃,20mL、3mol/L的Na2S2O3溶液
B.20℃,10mL、4mol/L的Na2S2O3溶液
C.20℃,30mL、2mol/L的Na2S2O3溶液
D.10℃,10mL、2mol/L的Na2S2O3溶液
难度: 简单查看答案及解析
-
可逆反应:3A(g)
3B(?) + C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是:①B和C可能都是固体 ②B和C一定都是气体 ③若C是固体,则B一定是气体 ④B和C可能都是气体
A、①② B、②③ C、③④ D、①④
难度: 简单查看答案及解析
-
下列说法不正确的是
A.增大压强,活化分子百分数不变,化学反应速率增大
B.升高温度,活化分子百分数增大,化学反应速率增大
C.加入反应物,活化分子百分数增大,化学反应速率增大
D.使用催化剂,活化分子百分数增大,化学反应速率增大
难度: 简单查看答案及解析
-
下列叙述正确的是
①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率;②镀层破损后,白铁(镀锌铁)比马口铁(镀锡铁)更易腐蚀;③电镀时,应把镀件置于电解池的阴极;④ 为防止水闸铁门被腐蚀,可让其与直流电源的负极相连;⑤放电时溶液中的阴离子向负极移动;⑥甲烷燃料电池,若其电解质溶液是强碱溶液,则其负极反应式:CH4+8OH--8e-=CO2↑+6H2O
A ①②③④⑤ B.①③④⑤ C.①③⑤⑥ D.③④⑥
难度: 简单查看答案及解析
-
LiFePO4新型锂离子动力电池是奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 ,负极 Li-e-== Li+下列说法中正确的是
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
难度: 简单查看答案及解析
-
将等质量的两份锌粉a和b,分别加入两个盛过量的稀硫酸的烧杯中,并向加入a的烧杯中再加入少量CuO粉末。下列各图表示氢气体积V(H2)与反应时间t的关系,其中正确的是( )
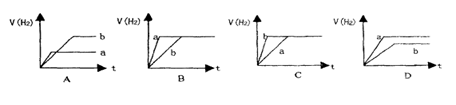
难度: 简单查看答案及解析
-
100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①N2O4的消耗速率与NO2的生成速率之比为1:2 ; ②NO2生成速率与NO2消耗速率相等;
③烧瓶内气体的压强不再变化; ④烧瓶内气体的质量不再变化 ;
⑤NO2的物质的量浓度不再改变 ; ⑥烧瓶内气体的颜色不再加深 ;
⑦烧瓶内气体的平均相对分子质量不再变化 ⑧烧瓶内气体的密度不再变化。
A.②③⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
难度: 简单查看答案及解析
-
在下列平衡体系3NO2+H2O
2HNO3+NO中加入O2,则化学平衡
A.不移动 B.向左移动 C.向右移动 D.无法判断
难度: 简单查看答案及解析
-
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
A.达到平衡时,X与Y 的浓度相等
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若升高温度Y的转化率减小,则正反应为吸热反应
D.以X浓度变化表示的反应速率为0.001 mol/(L·s)
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫 B.光照氯水,颜色变浅
C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的转化率
D.由H2、I2(g)、HI组成的平衡体系,加压后颜色加深
难度: 简单查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g);△H<0,下列研究目的和示意图相符的是
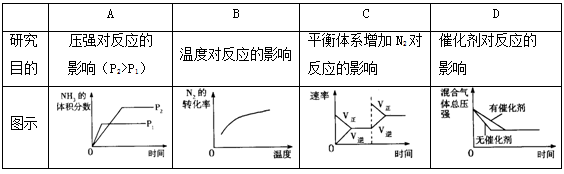
难度: 简单查看答案及解析
-
在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下
发生反应建立的化学平衡:aA(g) + bB(g)
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
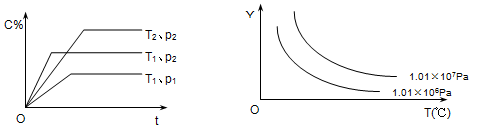
A.反应物A的百分含量 B.平衡混合气中物质B的百分含量
C.平衡混合气的密度 D.平衡混合气的平均摩尔质量
难度: 简单查看答案及解析
-
某反应过程中体系的能量变化如图所示,下列说法错误的是
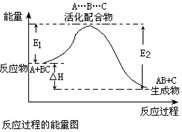
A、反应过程可表示为 A+BC—→[A…B…C] —→AB+C
(反应物)(过渡态) (产物)
B、此图中逆反应的热效应△H=E1—E2,为吸热反应
C、正反应的热效应为△H=E1—E2,且E2>E1,所以正反应为放热反应
D、E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
难度: 简单查看答案及解析
-
二氧化氮存在下列平衡:2NO2
N2O4(g) ;△H<0,在测定NO2 的相对分子质量时,下列条件较为适宜的是
A、温度130℃、压强3.03×105Pa B.温度25℃、压强1.01×105Pa
C、 温度0℃、压强5.05×104Pa D、 温度130℃、压强5.05×104Pa
难度: 简单查看答案及解析
-
在中和热测定的实验中不需要用到的仪器是
A.量筒 B.温度计 C.天平 D.环形玻璃搅拌棒
难度: 简单查看答案及解析