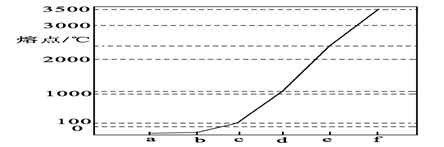
-
下列化学式能真实表示物质分子组成的是( )
A.NaOH B.SO3 C.CsCl D.SiO2
难度: 简单查看答案及解析
-
按电子排布,可把周期表里的元素划分成5个区,以下元素属于P区的是: ( )
A.Fe B. Mg C. P D.La
难度: 简单查看答案及解析
-
元素x的阴离子与元素y的阳离子具有相同的电子层结构,由此可知( )
A. x的原子半径大于y的原子半径
B. x的电负性小于y的电负性
C. x 的氧化性小于y的氧化性
D. x的第一电离能大于y 的第一电离能
难度: 简单查看答案及解析
-
长式周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是( )
A.第16列中元素中没有非金属元素
B.只有第二列的元素原子最外层电子排布为ns2
C.第四周期第8列元素是铁元素
D.第15列元素原子的最外层电子排布为ns2 np5
难度: 简单查看答案及解析
-
下列各项所述的数字不是6的是( )
A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl- 的个数
B.在金刚石晶体中,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在石墨晶体的片层结构中,最小的环上的碳原子个数
难度: 简单查看答案及解析
-
下列物质的熔、沸点高低顺序正确的是( )
A.金刚石,晶体硅,二氧化硅,碳化硅 B.CI4>CBr4>CCl4>CH4
C.MgO>H2O> N2> O2 D.金刚石>生铁>纯铁>钠
难度: 简单查看答案及解析
-
在以下的分子或离子中,空间结构的几何形状不是三角锥形的是 ( )
A.NF3 B.CH3- C.BF3 D.H3O+
难度: 简单查看答案及解析
-
下列对二氧化硫与二氧化碳的说法中正确的是 ( )
A.都是直线形结构
B.中心原子都采取sp杂化
C.硫原子和碳原子上都没有孤电子对
D.SO2为V形结构,CO2为直线形结构
难度: 简单查看答案及解析
-
PtCl4·2NH3水溶液不导电加入AgNO3无现象加强碱无NH3放出下列说法正确的是( )
A.配合物中中心原子的电荷数和配位数均为6
B.该配合物可能是平面正方形结构
C.Cl-和NH3分子均与Pt4+配位
D.配合物中Cl-与Pt4+配位,而NH3分子与Pt4+不配位
难度: 简单查看答案及解析
-
下列化学用语正确的是( )
A.锂离子的结构示意图:
B.碳原子的轨道表示式:
C.丁烷的最简式:C2H5 D.氯化镁的电子式:Mg2+[∶····∶]2-
难度: 简单查看答案及解析
-
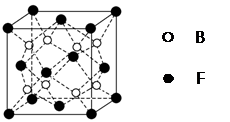
用NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
A.7.8 g Na2O2与足量潮湿的CO2反应,转移的电子数为0.1 NA
B.标准状况下2.24 L HCHO中含0.4 NA个原子
C.23.4 g NaCl晶体中含0.1 NA个如图所示结构单元
D.CsCl 1mol含晶胞0.25NA个
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.根据非金属原子最外层电子数的多少,可判断两种元素得电子能力的强弱
B.具有相同电子层结构的微粒,其化学性质是相似的
C.某变化过程中发生共价键的断裂,则该过程中一定发生化学变化
D.含金属元素的离子不一定是阳离子,不含金属元素的离子可能是阳离子
难度: 简单查看答案及解析
-
下列说法错误的是( )
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.1 mol金刚石晶体中,平均含有2 mol C—C键
C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键
D.某气态团簇分子结构如右图所示,该气态团簇分子的分子式为EF或FE
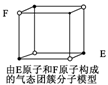
难度: 简单查看答案及解析
-
下列关于物质结构与性质的叙述中,正确的是( )
A.氢键的存在一定会使物质的熔点升高
B.因为蛋白质分子与胶体粒子大小相近,故蛋白质溶液具有胶体的某些性质
C.丁达尔现象是胶体粒子对光线反射形成的,可以用于区分胶体和悬浊液
D.可以用电子气理论解释大多数金属容易发生锈蚀的性质
难度: 简单查看答案及解析
-
下列说法中错误的是( )
A.SO2、SO3都是极性分子
B.在H3O+和[Cu(H2O)4]2+中都存在配位键
C.元素电负性越大的原子,该元素的原子吸引键合电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
B.同主族元素形成的氧化物的晶体类型均相同
C.全部由极性键构成的分子一定是极性分子
D.分子晶体中都存在范德华力,可能不存在共价键
难度: 简单查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1∶2,X2+和Z-的电子数之差为8。下列说法不正确的是( )
A.W与Y通过离子键形成离子化合物
B.元素原子半径从大到小的顺序是X>Y>Z
C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构
D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是Z
难度: 简单查看答案及解析
-
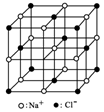
在某晶体中,与某一个微粒x距离最近且等距离的另一个微粒y所围成的空间构型为正八面体形(如图)。该晶体不是( )
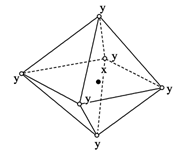
A.NaCl(x=Na+,y=Cl-)
B.CsCl(x=Cs+,y=Cl-)
C.金属钋(Po)
D.MgO晶体
难度: 简单查看答案及解析