-
(15分)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式 ________ ;F离子电子排布式________。
(2)写出X的化学式 ________
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:________。
(4)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是:。
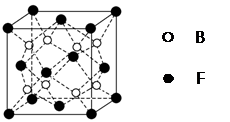
(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________________(只要求列出算式)。
-
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式 ________ ;F离子电子排布式________。
(2)写出X的化学式 ________
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:________。
(4)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是:________。
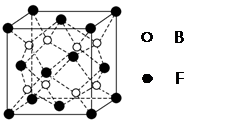
(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________________(只要求列出算式)。
-
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期.A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体.
(1)写出A元素的基态原子价电子排布式______;F离子电子排布式______.
(2)写出X的化学式______
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:______.
(4)CE、FA的晶格能分别为786KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是:______.
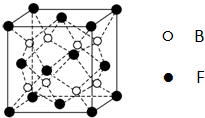
(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为______;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是______(只要求列出算式).
-
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子外围电子排布式:_______________________________。F的离子电子排布式:__________。
(2)写出X涉及化工生产中的一个化学方程式:______________________。
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:_____________。
(4)CE、FA的晶格能分别为786 kJ·mol-1、3 401 kJ·mol-1,试分析导致两者晶格能差异的主要原因是___________________________。
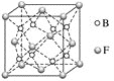
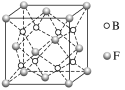
(5)F与B可形成离子化合物,其晶胞结构如图所示。F与B形成的离子化合物的化学式为________________;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是____________________(只要求列出算式)。
-
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)请写出F离子的电子排布式_________。
(2)写出X的化学式________,X的化学名称为______。
(3)写出X涉及化工生产中的一个化学方程式:__________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:____________。
(5)F与B可形成离子化合物,其晶胞结构如图所示。F与B形成的离子化合物的化学式为__________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________(只要求列出算式)。
-
X、Y、Z、W是原子序数依次增大的周期表前20号元素中的四种元素,且分别位于第二、三、四周期。X与Z位于同一主族,Y是地壳中含量最高的金属元素,Z的单质可用于制造半导体芯片,W的原子序数等于X和Y原子序数之和。下列说法正确的是
A.原子半径:r(W)>r(Y)>r(Z)>r(X)
B.简单气态氢化物的热稳定性:Z>X
C.最高价氧化物对应水化物的碱性:Y>W
D.工业上可以用电解W的氯化物的水溶液的方法来制取W的单质
-
位于短周期的四种元素A、B、C、D,它们的原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。回答下列问题:
(1)上述元素可以形成多种具有漂白性的物质,请写出任意两种物质的化学式:_________,______________;
(2)C与D形成D的最低价化合物的电子式:_________ ;
(3)写出C与水反应的离子方程式:______________________________;
(4)A、B组成的物质E可形成甲、乙两种微粒,它们均有10个电子。写出E生成甲、乙的方程式:_________________________________________。
-
(12分)位于短周期的四种主族元素A.B.C.D原子序数依次增大,已知A.C位于同一主族,A在周期表中原子半径最小。B.D的最外层电子数相等,且B.D的原子序数之和为A.C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式:
________,________,________,________。
(2)C与D形成D的最低价化合物的电子式:
(3)仅由B.C.D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因:________。
-
已知元素X、Y、Z、W均为短周期元素,其中X、Y、Z位于同一周期,其原子核外均有三个电子层且价电子数依次增大1,Y2+与W-其具有相同的电子层结构,下列说法正确的是( )
A. 离子半径:W->Y2+
B. X的含氧化合物中只含有离子键
C. W的最高正化合价为+7
D. 工业上常用电解Z的氯化物来制备Z的单质
-
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小。
(1)A2B和A2D的沸点较高者是________(填化学式),其原因是_________。
(2)B形成的双原子分子里,从轨道重叠的角度来看共价键的类型有________。
(3)E原子的电子排布式为______________________________________________。




