-
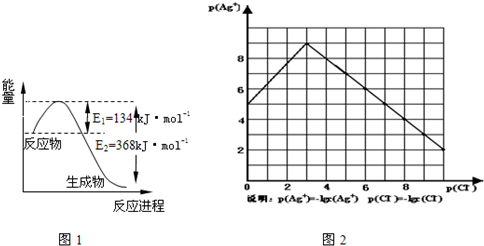
现有Na2CO3、Ba( OH)2、H2SO4三种体积和物质的量浓度都相同的溶液,以不同的顺序将它们混合,如生成沉淀,立即过滤掉,对于所得溶液的酸碱性,如下结论不正确的是( )
A.一定显碱性
B.可能显中性
C.不可能显酸性
D.可能显碱性难度: 中等查看答案及解析
-
温家宝总理在2010年政府工作报告中提出:“要大力开发低碳技术,推广高效节能技术,积极发展新能源和可再生能源.”下列有关做法与此不相符的是( )
A.大力开发丰富的煤炭资源,减少对石油的依赖
B.回收废弃饮料包装纸,制作成公园内的休闲长椅
C.在西部和沿海地区兴建风力发电站,解决能源问题
D.鼓励购买小排量汽车,推广与发展电动、混合动力汽车难度: 中等查看答案及解析
-
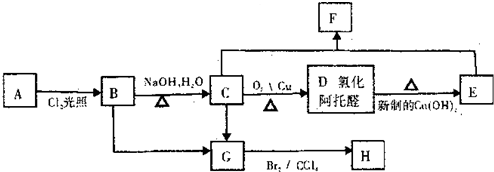
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列推断正确的是( )
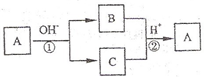
A.X元素为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和②一定为氧化还原反应难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.用惰性电极电解熔融氯化钠:2C1-+2H2OC12↑+H2↑+2OH-
B.氢氧化钠溶液中加入过量的碳酸氢钙溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.漂白粉溶液通入少量的SO2:Ca2++2C1O-+SO2+H2O=CaSO3↓+2HC1O
D.硫酸亚铁酸性溶液中加入过氧化氢:4Fe2++2H2O2+4H+=4Fe3++4H2难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.汽油、柴油和植物油都是碳氢化合物
B.乙醇可以被氧化为乙酸,二者都能发生酯化反应
C.甲烷、乙烯和苯在工业上都可通过石油分馏得到
D.主链含5个碳原子的辛烷,其同分异构体最多只有5种难度: 中等查看答案及解析
-
下表中实验操作能达到实验目的或得出正确结论的是( )
选项 实验操作 实验目的或结论 A SO2通入溴水中,溶液褪色 检验SO2的漂白性 B 向2mL淀粉溶液中加入稀硫酸,加热2min,加入新制Cu( OH)2再加热,无明显现象. 淀粉在酸性条件下不水解 C 将制得的溴苯粗产品与氢氧化钠溶液充分混合后分液 除去溴苯中混有的溴 D 以石墨为电极电解硫酸铜和硫酸亚铁的混合液开始时,阴极碳棒上有红色物质析出 还原性:Cu2+比Fe2+强
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O.已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离【解析】
SO2(l)+SO2(l)⇌SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是( )
A.该滴定反应可以表示为:SO32-+SO2+=2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点难度: 中等查看答案及解析