-
下列属于酸性氧化物的是
A. CO2 B. KOH C. HNO3 D. Na2SO4
难度: 简单查看答案及解析
-
仪器名称为“容量瓶”的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列物质属于电解质且能导电的是
A. 酒精 B. 金属铜 C. 液态氯化氢 D. 熔融氯化钾
难度: 中等查看答案及解析
-
在反应C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O中,浓硫酸的作用是
A. 酸性 B. 强氧化性 C. 酸性和强氧化性 D. 还原性
难度: 中等查看答案及解析
-
下列物质的水溶液中,因水解呈酸性的是
A. CO2 B. NaHSO4 C. HCl D. Fe2(SO4) 3
难度: 简单查看答案及解析
-
下列说法正确的是
A. 聚乙烯是一种广发用于制造水杯、奶瓶、食物保鲜膜等用品的有机高分子材料
B. 工业上用焦炭在高温下还原二氧化硅可制得纯硅
C. 海水中溴离子浓度大,因此溴被称为“海洋元素”
D. 用于电气工业的纯铜可由黄铁矿冶炼直接得到
难度: 中等查看答案及解析
-
下列化学用语表述正确的是
A. 甘氨酸的结构简式:H2NCH2COOH B. HCl的电子式
C. 氯离子的结构示意图
D. 二氧化碳的比例模型:
难度: 中等查看答案及解析
-
下列不能使品红溶液褪色的是
A. SO2 B. SO3 C. HClO D. H2O2
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 符合通式CnH2n+2且n不同的烃一定属于同系物
B. C60和纳米碳管互为同素异形体
C. 宇宙射线的作用下可使14N转化为14C,14N和14C互为同位素
D. C5H12的某种同分异构体只有一种一氯代物
难度: 中等查看答案及解析
-
下列说法正确的是
A. 石油的蒸馏实验中,忘记加沸石,应立即趁热加入沸石,以免暴沸
B. 保存氯化亚铁溶液时,应加少量铁粉
C. 向铜与浓硫酸反应后的混合溶液中加水,判断有无铜离子
D. 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
难度: 中等查看答案及解析
-
在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是

A. a、b两处的混合气体成分含量相同,温度不同
B. c、d两处的混合气体成分含量相同,温度不同
C. 热交换器的作用是预热待反应的气体,冷却反应后的气体
D. c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
难度: 中等查看答案及解析
-
在一定条件下,3molX与3molY在恒容密闭容器中发生反应X(g)+3Y(g)
2Z(g),△H=-Q kJ·molˉ1(Q>0)下列说法正确的是
A. 达到平衡时,反应放出QkJ热量
B. 反应一段时间后,X与Y的物质的量之比仍为1:1
C. X的体积分数不变,说明反应已达到平衡状态
D. 达到平衡后,若向平衡体系中充入氦气,Z的反应速率不变
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 氯碱工业中电解饱和食盐水:2Cl﹣+2H2O
H2↑+Cl2↑+2OH﹣
B. 氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+
C. 氢氧化钠溶液吸收少量二氧化硫SO2+OH﹣=HSO3﹣
D. 稀硫酸中加氢氧化钡溶液至中性:Ba2++H++OH﹣+SO42﹣=BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A. 乙炔与苯以任意比混合,只要混合物总质量一定,完全燃烧生成的CO2的总量会变化
B. 淀粉和纤维素互为同分异构体
C. 分馏汽油能使溴的四氯化碳溶液褪色
D. 石油裂化和裂解的目的均是为了将长链烃转化为短链烃
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 油脂是高级脂肪酸甘油酯,在热的NaOH溶液中水解后混合液不分层
B. 在紫外线、饱和硫酸铵溶液、CuSO4溶液的作用下,蛋白质发生变性
C. 醋酸、葡萄糖和淀粉三种无色溶液,可以用新制Cu(OH)2悬浊液检验
D. 蛋白质中除含有碳、氢、氧外,还含有氮等元素
难度: 中等查看答案及解析
-
某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法正确的是
A. 电池工作时OH-向正极迁移
B. 正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2O
C. 该电池放电过程中电解质溶液浓度不变
D. Zn为电池的负极
难度: 困难查看答案及解析
-
下列关于电解质溶液的说法正确的是
A. 25℃时,某浓度的KHA溶液pH=4,则 HA_的电离程度大于水解程度,H2A为弱酸
B. 常温下通过测定0.1mol/LNH4Cl溶液的酸碱性能证明一水合氨是弱电解质
C. 同浓度的盐酸和醋酸稀释相同倍数后,盐酸的pH大于醋酸
D. 0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 HCl溶液中的c(H+)的2倍
难度: 中等查看答案及解析
-
根据下图所示的过程中的能量变化情况,判断下列说法正确的是
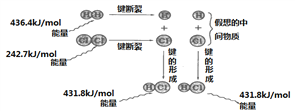
A. H2(g)转化为氢原子是一个放热过程
B. 1molH2和1molCl2的总能量比2molHCl的总能量低
C. 1 个 HCl(g)分子中的化学键断裂时需要吸收431.8 kJ能量
D. 2HCl(g)= H2(g)+Cl2(g)的反应热ΔH=+184.5 kJ·mol-1
难度: 中等查看答案及解析
-
下列说法不正确的是
A. CO2、SiO2的晶体结构类型不同
B. 加热硅、硫晶体使之熔化,克服的作用力不同
C. HCl、NaCl溶于水,破坏的化学健类型相同
D. NaOH、NH4Cl晶体中既有离子键又有共价键
难度: 中等查看答案及解析
-
己知反应:2A(l)
B(l) △H=-QkJ/mol,取等量A分别在0℃和20 ℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
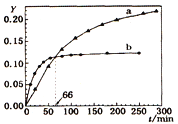
A. a代表20℃下A的Y-t曲线
B. 反应到66min时,0℃和20℃下反应放出的热量相等
C. 0℃和20℃下达到平衡时,反应都放出QkJ热量
D. 反应都达到平衡后,正反应速率a > b
难度: 困难查看答案及解析
-
阿伏加德罗常数的值为NA.下列说法正确的是( )
A. 1L0.1mol•L﹣1NH4Cl溶液中,NH4+的数量为0.1NA
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
难度: 中等查看答案及解析
-
含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如下图所示.下列说法正确的是
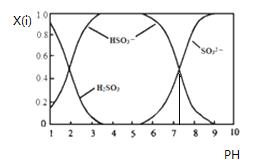
A. pH=8时,溶液中c(HSO3-)>c(SO32-)
B. pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO32-)
C. 为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
D. 由图中数据可估算出c(H+)×c(SO32-)/c(H2SO3)为10-7.3
难度: 困难查看答案及解析
-
实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4•7H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示:下列说法不正确的是
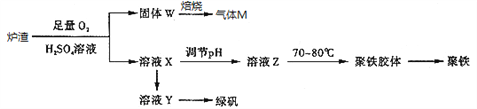
A. 炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
D. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾
难度: 困难查看答案及解析
-
某无色溶滚中可能含有Na+、NH4+、Ba2+、Cu2+、SO42﹣、SO32﹣、Cl﹣、Br﹣、CO32﹣中的若干种.为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体.下列关于原溶液的说法正确的是
A. 肯定存在NH4+、Cl﹣、Br﹣
B. SO42﹣、SO32﹣至少含有一种
C. 是否存在Na+需要通过焰色反应来确定
D. 肯定不存在Ba2+、Cu2+、SO32﹣、CO32﹣
难度: 困难查看答案及解析
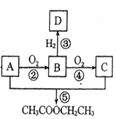

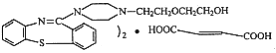 ,它的合成路线如下:
,它的合成路线如下: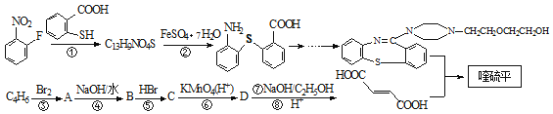
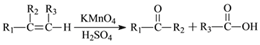
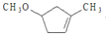 到
到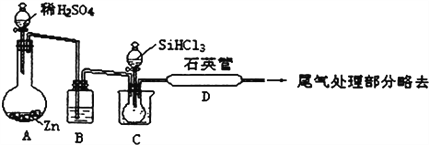
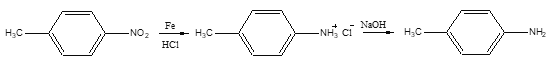
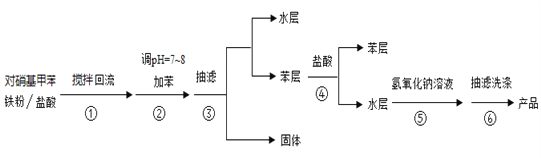
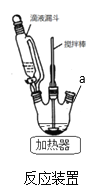
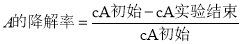 ),反应40秒后检测HNO3气体浓度有所降低,请用化学方程式结合化学反应原理知识解释出现该现象可能的原因_______________________。
),反应40秒后检测HNO3气体浓度有所降低,请用化学方程式结合化学反应原理知识解释出现该现象可能的原因_______________________。
