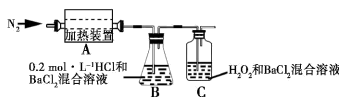-
已知33As、35Br位于同一周期,下列关系正确的是
A.原子半径:As>C1>P B.热稳定性:HC1>AsH3>HBr
C.还原性:As3->S2->C1- D.酸性:H3AsO4>H2SO4>H3PO4
难度: 中等查看答案及解析
-
固体储氢材料氨硼烷,化学式为 NH3BH3,可用如下反应制取: Ni(NH3)6Cl2+2NaBH4 =2NH3BH3+4NH3↑+2NaCl+H2↑+Ni。下列说法正确的是
A.NaBH4中B元素化合价为+3 B.每生成11.2 L H2转移 NA个电子
C.NaBH4在反应中作氧化剂 D.NH3BH3在反应中属于还原产物
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.向NaOH溶液中通入过量CO2:2OH-+CO2 =CO32−+H2O
B.电解氯化镁溶液: 2Cl-+2H2O
Cl2↑+H2
C.向H2O2溶液中加入MnO2: 2H2O2+4H++MnO2 =O2↑+Mn2++4H2O
D.向 KAl(SO4)2溶液中滴加 Ba(OH)2溶液至SO42−沉淀完全:
Al3++2SO42−+2Ba2++4OH-=AlO2- +2BaSO4↓+2H2O
难度: 困难查看答案及解析
-
短周期元素W、X、Y 和Z的原子序数依次增大。金属元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z 原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.元素W、X的氯化物中,各原子均满足8电子的稳定结构
B.元素X与氢形成的原子个数比为1:1 的化合物有很多种
C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素Z可与元素X形成共价化合物XZ2
难度: 中等查看答案及解析
-
聚合物锂离子电池以其良好的性能、低发热而广泛应用于手机的移动电源。某品牌聚合物锂离子电池的反应如下:LiCoO2+nC
Li1-xCoO2+LixCn。下列说法正确的是
A.放电时,负极发生反应的物质是 Li1-xCoO2
B.充电时,阴极发生氧化反应
C.放电时,Li+由负极向正极迁移
D.充电时,阳极的电极反应式为:xLi++nC+xe-= LixCn
难度: 中等查看答案及解析
-
下列热化学方程式或说法正确的是
A.甲烷的燃烧热为 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)= CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=-38.6 kJ·mol-1
C.同温同压下,等物质的量的H2与足量的Cl2在光照和点燃条件下充分反应,所产生的热量相同
D.已知中和热为 57.3 kJ/mol,则稀硫酸与氢氧化钡溶液反应的热化学方程式为
2H+(aq) +SO42−(aq)+Ba2+(aq)+2OH-(aq)= BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol
难度: 中等查看答案及解析
-
NH3是重要的化工原料,已知: N2(g)+O2(g) =2NO(g) ΔH=+a kJ/mol ①
4NH3(g)+5O2(g) =4NO(g)+6H2O(g) ΔH=-b kJ/mol ②
2H2(g)+O2(g) =2H2O(g) ΔH=-c kJ/mol ③
则N2(g)+3H2(g) =2NH3(g)的 ΔH 是
A.(a+0.5b-1.5c)kJ/mol B.(a-2.5b+1.5c )kJ/mol
C.(2a+3b-2c)kJ/mol D.(2c+b-a)kJ/mol
难度: 困难查看答案及解析
-
在容积固定的密闭容器中存在如下反应:N2(g)+3H2(g)
2NH3(g) ΔH<0。 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如下关系图。下列叙述正确的是( )
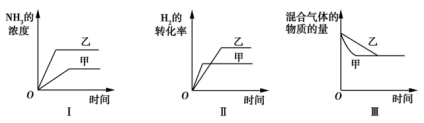
A.图Ⅰ研究的是温度对反应的影响,且甲的温度比乙的高
B.图Ⅱ研究的是温度对反应的影响,且甲的温度比乙的高
C.图Ⅱ研究的是压强对反应的影响,且甲的压强比乙的大
D.图Ⅲ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率比甲使用的高
难度: 困难查看答案及解析
-
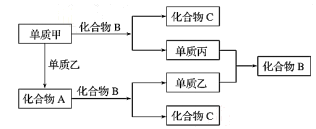
甲、乙、丙三种物质之间能通过一步反应实现转化关系: 甲
乙
丙,则甲、丙不可能是
A.NO HNO3 B.CH2=CH2 CH3CHO C.Fe FeCl3 D.Si H2SiO3
难度: 中等查看答案及解析
-
烧杯中盛有一定量的液态物质A,加入少量固体物质B,B不溶解。当通入气体C时发现B逐渐溶解直至完全溶解。则 A、B、C依次为( )
A.H2O、BaSO4、O2 B.FeCl2溶液、Fe粉、Cl2
C.H2O、CaCO3、SO3气体 D.H2O、SiO2、HCl气体
难度: 中等查看答案及解析
-
下列除杂试剂的选择或除杂操作不正确的是
括号内为杂质
除杂试剂
除杂操作
A
Na2O2(Na2O)固体
O2
在纯氧气中加热
B
Na2CO3 (NaHCO3)溶液
CO2
通入过量的 CO2
C
FeCl3(FeCl2)溶液
Cl2
通入过量的 Cl2
D
FeSO4(CuSO4)溶液
Fe
加入过量的 Fe 粉,充分反应后过滤
难度: 中等查看答案及解析
-
某核素
可形成HmX型氢化物,则 a g HmX 含有( )
A.
质子 B.
电子
C.
中子 D.
难度: 困难查看答案及解析
-
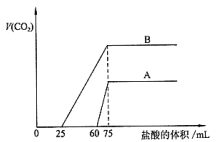
在标准状况下进行下列实验,各取30.0 mL同浓度的盐酸,加入同一种镁铝合金的粉末产生气体,有关数据如表所示:
实验序号
甲
乙
丙
合金质量(mg)
255
385
459
标准状况下气体的体积(mL)
280
336
336
下列说法正确的是
A.甲、乙组的实验中,盐酸均是过量的
B.盐酸的物质的量浓度为0.8 mol·L-1
C.合金中镁、铝的物质的量之比为1∶1
D.丙组中铝的物质的量为0.0045mol
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值,则下列叙述正确的是
A.常温常压下,46 g 有机物C2H6O中含有极性键的数目一定为 7NA
B.标准状况下,22.4 L 四氯化碳中所含有的共价键数目为 4NA
C.标准状况下,5.6 L NO和5.6 L O2组成的混合气体中所含原子数为 NA
D.常温常压下,33.6 L 氯气与56 g铁充分反应,转移的电子数为 3NA
难度: 困难查看答案及解析
-
下列实验不能达到目的的是
A.用AlCl3溶液和过量氨水制备 Al(OH)3
B.用NH4Cl 和Ca(OH)2固体混合加热制备NH3
C.用NaOH溶液除去苯中的溴
D.用足量铜粉除去 FeCl2溶液中的FeCl3杂质
难度: 中等查看答案及解析
-
一定温度下,在一固定体积的密闭容器中,可逆反应A(s)+3B(g)
2C(g)达到平衡时,下列说法正确的是
①C的生成速率和C的分解速率相等; ②单位时间内生成a mol A,同时生成3a mol B;
③气体密度不再变化; ④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为1∶3∶2; ⑥混合气体的平均相对分子质量不变
A.②④⑤ B.①③④⑥ C.①②④⑥ D.①②③④⑤
难度: 中等查看答案及解析
-
在密闭容器中进行反应CH4(g)+H2O(g)
CO(g)+ 3H2(g)ΔH>0 ,测得c(CH4) 随反应时间(t)的变化曲线如图所示。下列判断正确的是
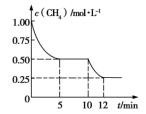
A.0~5 min 内,v(H2)=0.1 mol·(L·min)-1
B.反应进行到12 min时,CH4的转化率为 25%
C.恒温下,缩小容器的体积,平衡后 H2的浓度减小
D.10 min 时,改变的外界条件可能是升高温度
难度: 困难查看答案及解析
-
已知H2(g)+I2(g)
2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.2 mol,乙中加入HI0.4 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度 B.甲降低温度,乙不变
C.甲中加入0.2 mol He,乙不改变 D.甲增加 0.2 mol H2,乙增加0.2 mol I2
难度: 困难查看答案及解析
-
下列关于Fe3+、Fe2+性质实验的说法错误的是
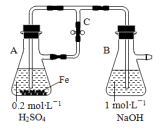
A.用如图装置可以制备沉淀 Fe(OH)2
B.配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C.FeCl3溶液中滴加KSCN溶液会生成红色沉淀
D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
难度: 中等查看答案及解析
-
向VmLFeBr2溶液中缓慢通入amolCl2,结果溶液中有50%的Br-被氧化为溴单质,则原FeBr2溶液的物质的量浓度为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列有关物质的性质与应用不相对应的是
A.氢氟酸易与SiO2反应,可用于刻蚀玻璃
B.Al和Fe2O3能发生铝热反应,可用于焊接钢轨
C.NH3具有碱性,可用NH3与灼热的CuO作用制取少量 N2
D.Fe具有良好的导电性,可用Fe作电解食盐水的阴极材料
难度: 简单查看答案及解析
-
下列说法正确的是
A.将 SO2通入Ba(NO3)2溶液中能生成 BaSO4沉淀
B.在SiO2+3C
SiC+2CO的反应中,SiO2是氧化剂
C.生铁在潮湿的空气中主要发生析氢腐蚀
D.某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色气体,说明该钾盐是K2CO3
难度: 简单查看答案及解析
-
下列实验不合理的是:

A.证明非金属性强弱 S>C>Si B.四氯化碳萃取碘水中的碘
C.制备并收集少量NO气体 D.制备少量氧气
难度: 中等查看答案及解析
-
如图装置电解一段时间,当某极析出0.32 g Cu 时,Ⅰ、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体积均为100 mL 且电解前后溶液体积变化忽略不计)
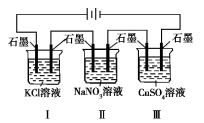
A.13、7、1 B.12、7、2 C.1、7、13 D.7、13、1
难度: 中等查看答案及解析
-
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g) + 3H2(g)
2NH3(g) ΔH=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号
起始时各物质的物质的量/mol
平衡时反应中的能量变化
N2
H2
NH3
①
1
3
0
放出热量 a kJ
②
2
3
0
放出热量 bkJ
③
2
6
0
放出热量 ckJ
下列叙述正确的是
A.放出热量关系:a<b<92.4 B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③ D.N2的平衡转化率:②>①>③
难度: 困难查看答案及解析