-
下列分子中所有原子都满足最外层 8 电子结构的是( )
①SF6 ②PCl5 ③PCl3 ④CS2 ⑤NO2 ⑥N2
A.①②④⑤ B.②③⑤⑥ C.③④⑥ D.①③⑤
难度: 中等查看答案及解析
-
短周期主族元素A、B形成AB3型分子,下列有关叙述正确的是( )
A.若A、B为同一周期元素,则AB3分子一定为平面正三角形
B.若AB3分子中的价电子个数为24个,则AB3分子为平面正三角形
C.若为A、B为同一主族元素,则 AB3分子一定为三角锥形
D.若AB3分子为三角锥形,则 AB3分子一定为 NH 3
难度: 中等查看答案及解析
-
同学们使用的涂改液中含有很多有害的挥发性物质,二氯甲烷就是其中的一种,吸入会引起慢性中毒,有关二氯甲烷的说法正确的是 ( )
A.含有非极性共价键 B.键角均为 109°28′
C.有两种同分异构体 D.分子属于极性分子
难度: 中等查看答案及解析
-
下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.BF3、NF3分子的价层电子对互斥模型均为平面正三角形
B.H—Cl 的键能为431.8kJ/mol ,H—I 的键能为 298.7kJ/mol,这可以说明HCl分子比HI分子稳定
C.可燃冰是甲烷的结晶水合物,甲烷可与水形成氢键
D.因为N-H键能比P-H 大,所以NH3沸点比 PH3高
难度: 简单查看答案及解析
-
X、Y 是元素周期表ⅦA 族的两种元素。下列叙述能说明 X 的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX 的溶液中置换出来
难度: 中等查看答案及解析
-
氰气的化学式为(CN)2,结构式为 N≡C—C≡N,性质与卤素相似,叙述正确的是( )
A.在一定条件下可发生加成反应
B.分子中N≡C键的键长大于C—C键的键长
C.分子中含有2个σ键和4个π键
D.不能与氢氧化钠溶液发生反应
难度: 中等查看答案及解析
-
原子轨道的杂化不但出现在分子中,原子团中同样存在杂化轨道的。在 SO42-中S原子的杂化方式为( )
A.sp B.sp2 C.s p3 D.无判法断
难度: 中等查看答案及解析
-
下列事实能够用键能的大小作为主要依据来解释是的( )
A.常温常压下氯气呈气态而溴单质呈液态
B.酸硝是挥发性酸,而硫酸酸磷是不挥发性酸
C.稀有气体一般难以发生化学反应
D.空气中氮气的化学性质比氧气稳定
难度: 简单查看答案及解析
-
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g)
4NO(g)+6H2O(g)△H=-9072kJ/mol K=1.1×1026
②4NH3(g)+4O2(g)
2N2O(g)+6H2O(g)△H=-1104.9kJ/mol K=4.4×1028
③4NH3(g)+3O2(g)
2N2(g)+6H2O(g)△H=-1269.02kJ/mol K=7.1×1034
其中,②、③是副反应。若要减少副反应,提高单位时间内NO的产率,最合理的措施是()
A.增大O2浓度 B.使用合适的催化剂 C.减小压强 D.降低温度
难度: 中等查看答案及解析
-
下列实验目的对应的实验操作和实验原理均正确的是
实验目的
实验操作
实验原理
A
提纯混有少量硝酸钾的氯化钠
在较高温度下制得浓溶液再冷却结晶、过滤、干燥
氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大
B
配制FeCl3溶液
将FeCl3固体溶解于适量硫酸溶液
H+抑制FeCl3水解
C
检验溶液中是否含有NH4+
取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
NH3溶于水后溶质的主要存在形式是NH4+、OH-
D
验证Fe(OH)3的溶解度小于Mg(OH)2
将FeCl3溶液加入Mg(OH)2悬浊液中,振荡
3Mg(OH)2+2Fe3+
2Fe(OH)3+3Mg2+
难度: 中等查看答案及解析
-
40℃时,在氨﹣水体系中不断通入CO2,各种离子的变化趋势如图所示。下列说法不正确的是
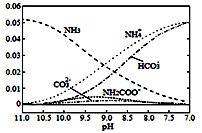
A.在pH=9.0时,c(NH4+)>c(HCO3﹣)>c(NH2COO﹣)>c(CO32﹣)
B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32﹣)+c(HCO3﹣)+c(NH2COO﹣)+c(OH﹣)
C.随着CO2的通入,
不断增大
D.在溶液pH不断降低的过程中,有含NH2COO﹣的中间产物生成
难度: 极难查看答案及解析
-
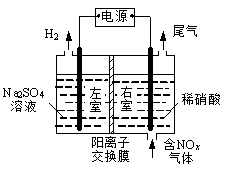
利用LiOH可制备锂离子电池正极材料。LiOH可由电解法制备,如右图,两极区电解质溶液分别为LiOH和LiCl溶液。下列说法错误的是
A.B极区电解质溶液为LiOH溶液
B.阳极电极反应式为2Cl--2e-=Cl2↑
C.电解过程中主要是H+通过阳离子交换膜向B电极迁移
D.电极A连接电源的正极
难度: 简单查看答案及解析
-
常温下,有下列四种溶液:
①
②
③
④
0.1mol/L 盐酸
pH = 3盐酸
0.1mol/L 氨水
pH = 11氨水
下列说法正确的是
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D.②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
难度: 中等查看答案及解析
-
下列关于各图像的解释或结论不正确的是
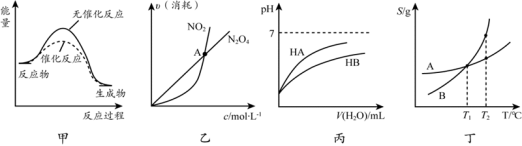
A.由甲可知:使用催化剂不影响反应热
B.由乙可知:对于恒温恒容条件下的反应2NO2 (g)
N2O4 (g),A点为平衡状态
C.由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D.由丁可知:将T1 ℃ 的A、B饱和溶液升温至T2 ℃时,A与B溶液的质量分数相等
难度: 中等查看答案及解析
-
工业合成氨的反应为N2(g)+3H2(g)
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
计算:
(1)该条件下N2的平衡转化率;(小数点后保留一位)
(2)该条件下反应2NH3(g)
N2(g)+3H2(g)的平衡常数。(不带单位)
难度: 中等查看答案及解析