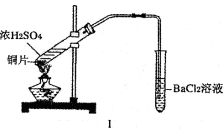
-
将CO2转化成有机物可有效实现碳循环。下列反应中,最节能的是
A.CO2 + 3H2
CH3OH +H2O
B.6CO2 + 6H2O
C6H12O6 + 6O2
C.CO2 + CH4
CH3COOH
D.2CO2 + 6H2
CH2=CH2 + 4H2O
难度: 简单查看答案及解析
-
吸进人体内的氧有2%转化为加速人体衰老的氧化性极强的活性氧,若Na2SeO3能清除人体内活性氧,则Na2SeO3的作用是
A.还原剂 B.氧化剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
难度: 中等查看答案及解析
-
下列元素的单质,工业上不需要用电解法制取的是
A.钠 B.铝 C.溴 D.氯
难度: 简单查看答案及解析
-
下列有机物系统命名正确的是
A.2-甲基-氯丙烷 B.2-甲基-3-丁烯
C.2,4,4-三甲基戊烷 D.2,3-二甲基-4-乙基己烷
难度: 简单查看答案及解析
-
除去密封食品包装盒内的氧气可延长食品的保质期,下列措施不能延长食品保质期的是
A.适当添加含酚类结构单元的天然化合物 B.对食物充氮包装
C.放入装有铁粉的透气的小纸袋 D.放入装有生石灰透气的小纸袋
难度: 中等查看答案及解析
-
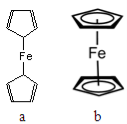
如图是一种有机物的比例模型,该模型代表的有机物可能是

A.饱和一元醇 B.羟基酸 C.羧酸 D.饱和一元醛
难度: 中等查看答案及解析
-
下列微粒的存在最能说明碘可能呈现金属性的是
A.IBr B.I2O5 C.I3+ D.I3-
难度: 中等查看答案及解析
-
在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是
A.滴有酚酞的Na2CO3溶液 B.溶有SO2的品红溶液
C.滴有石蕊的CH3COOH溶液 D.滴有酚酞的饱和氢氧化钙溶液
难度: 中等查看答案及解析
-
下列物质都具有较强的吸水性。欲使稀硝酸成为浓硝酸,不能使用的试剂是
A.浓硫酸 B.五氧化二磷 C.无水硫酸镁 D.甘油
难度: 简单查看答案及解析
-
某溶液中含有NO3-、S2-、AlO2-、SO32-四种阴离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的NaOH溶液,则溶液中物质的量基本不变的阴离子是
A.NO3- B.S2- C.AlO2- D.SO32-
难度: 中等查看答案及解析
-
已知粗碘中含有的IBr和ICl受热都会升华,若先在粗碘中加入下列物质中的一种再加热,就可制得纯净的碘。该物质是
A. KI B.H2O C.Zn D.NaCl
难度: 中等查看答案及解析
-
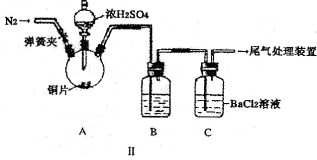
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
选项
a中物质
b中物质
c中收集气体
d中物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
浓盐酸
HCl
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
难度: 中等查看答案及解析
-
将5.4 g Al 投入到200mL 2.0 mol/L的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
难度: 中等查看答案及解析
-
下列事实中不能说明氯的单质分子是双原子分子的是
A.在标准状况下,氯单质为气态
B.在标准状况下,71 g 氯气所占的体积约为22.4 L
C.电解饱和食盐水,阴极和阳极分别逸出气体的体积大致相等
D.含0.2 mol NaOH的溶液,恰好与2.24L(标准状况下)氯气反应
难度: 中等查看答案及解析
-
1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.Na2CO3 B.Na2O2,Na2CO3
C.NaOH,Na2CO3 D.Na2O2,NaOH,Na2CO3
难度: 困难查看答案及解析
-
将通有H2S的导气管伸入充满氧气的集气瓶内点燃,描述反应过程的曲线错误的是

难度: 中等查看答案及解析
-
烷烃分子中去掉2个氢原子形成一个双键是吸热反应,1,3—环己二烯失去2个氢原子生成苯是放热反应。下列说法正确的是
A.1,3—环己二烯加氢是吸热反应 B.1,3—环己二烯比苯稳定
C.苯比1,3—环己二烯稳定 D.苯加氢生成环己烷是吸热反应
难度: 中等查看答案及解析
-
某浓H2SO4的标签上写明含H2SO4 96~98.3%,欲得其准确的值,有效的方法是
A.测pH值 B.测导电性大小 C.测密度 D.进行中和滴定
难度: 中等查看答案及解析
-
如图是工业制纯碱的部分物质转化示意图,下列推测错误的是
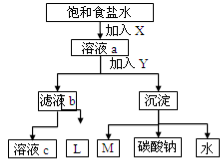
A.若是联碱法,溶液c可在转化流程中循环利用
B.若是氨碱法,则L的主要成分是NaCl
C.M可在转化流程中循环利用
D.X是NH3 ,Y是CO2
难度: 中等查看答案及解析
-
在0.1 mol/L的NaHSO3溶液中有如下关系:c(Na+)>c(HSO3-) >c(SO32-) >c(H2SO3),向NaHSO3溶液中慢慢地加入少量的NaOH溶液,发生的主要反应的离子方程式为
A.SO32-+H2O
HSO3-十OH— B.HSO3-十H2O
H2SO3十OH-
C.HSO3-十OH—
SO32—十H2O D.H2SO3+OH-
HSO3-十H2O
难度: 中等查看答案及解析
-
在含有n mol FeI2的溶液中通入Cl2,有x mol Cl2发生反应。下列说法正确的是
A.当x ≤
时,反应的离子方程式为:2Fe2++ Cl2 → 2Fe3++ 2Cl-
B.当x ≥ n时,反应的离子方程式为:2Fe2++ 2I-+ 2Cl2 → 2Fe3++ I2+ 4Cl-
C.当Fe2+和I-同时被氧化时,x与n的关系为x>n
D.当x=n时,反应后氧化产物的物质的量为n mol
难度: 中等查看答案及解析
-
将气体A2和B2以等物质的量充入密闭容器,一定条件下发生反应生成C气体。平衡时测得c(A2)= 0.58 mol/L,c(B2)=0.16 mol/L,c(C)=0.84 mol/L,则C的分子式为
A.AB B.AB2 C.A2B D.A2B3
难度: 中等查看答案及解析