-
为了回收利用钢铁生产过程中产生的SO2,工业上采用软锰矿(主要成分MnO2)脱硫同时制取硫酸锰技术,其流程示意图如下:
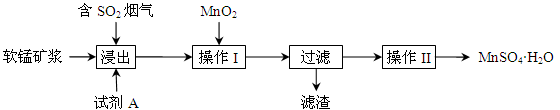
已知:浸出液的pH接近4,其中的金属离子主要是Mn2+,还含有少量的Fe2+。完成下列填空。
(1)写出浸出过程中主要反应的化学方程式: 。
(2)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将 (“有利”、“不利”)于软锰矿浆继续吸收SO2。欲消除生成的硫酸,试剂A最好是 。
a.MnCO3 b.MnO2 c.CaO d.CaCO3
(3)操作I的目的是除去浸出液中的Fe2+,MnO2在氧化Fe2+的同时还 ,使Fe3+沉淀。检验过滤后溶液中是否含有Fe3+的操作是 。
(4)已知大于27℃时,MnSO4·H2O溶解度随温度上升而明显下降,则操作II的过程为: 、 、洗涤、干燥。工业上为了充分利用锰元素,在流程中 可循环使用。
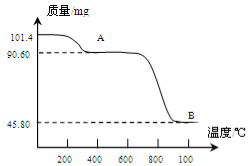
(5)通过煅烧MnSO4·H2O 可制得生产软磁铁氧体材料的MnxO4,如图是煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。该曲线中A段所表示物质的化学式为 ;MnxO4中x= 。
-
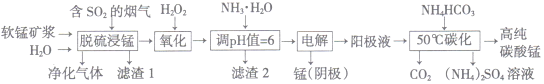
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
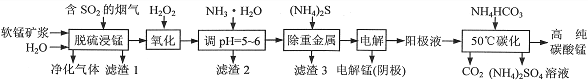
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为______________________。
(2)“滤渣2”中主要成分的化学式为______________________。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是_______________________________________。
(4)“电解”时用惰性电极,阳极的电极反应式为____________________________。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_______________________________________。“50℃碳化”时加入过量NH4HCO3,可能的原因是______________________________________(写两种)。
(6)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O NH3·H2O+H+,则该反应的平衡常数为____________________。
NH3·H2O+H+,则该反应的平衡常数为____________________。
-
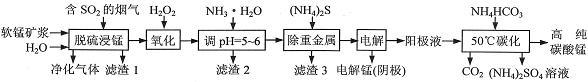
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
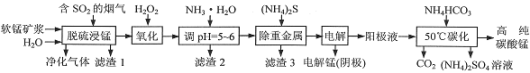
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为__。
(2)“滤渣2”中主要成分的化学式为__。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是__。
(4)“电解”时用惰性电极,阳极的电极反应式为__。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为___。“50℃碳化”时加入过量NH4HCO3,可能的原因是__(写两种)。
(6)已知:25℃时,Kw=1.0×10-14,Ka(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:NH4++H2O NH3·H2O+H+,则该反应的平衡常数为__。
NH3·H2O+H+,则该反应的平衡常数为__。
-
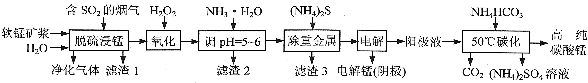
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物等杂质):
已知:Fe(OH)3的Ksp=l.0×10-38,Al(OH)3的Ksp=1.0×10-34
(1)一定温度下, “脱硫浸锰”主要产物为MnSO4,生成该产物的化学方程式为_________。
(2)常温下,调节pH=6时,得到的“滤渣2”主要成分为Fe(OH)3和_____(化学式),此时溶液中的Fe3+物质的量浓度为_________ 。
(3)“电解”时用惰性电极,阳极的电极反应式为_______________。
(4)“50℃碳化”得到高纯碳酸锰,反应的离子方程武为____________________。“50℃碳化”时加入过量NH4HCO3,可能的原因:①使MnSO4充分转化为MnCO3;②________________;③________________。
-
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为______________________。
(2)“滤渣2”中主要成分的化学式为______________________。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是_______________________________________。
(4)“电解”时用惰性电极,阳极的电极反应式为____________________________。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_______________________________________。“50℃碳化”时加入过量NH4HCO3,可能的原因是______________________________________(写两种)。
(6)已知:25℃时,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O NH3·H2O+H+,则该反应的平衡常数为____________________。
NH3·H2O+H+,则该反应的平衡常数为____________________。
-
工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为 。
(2)“滤渣2”中主要成分的化学式为 。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是 。
(4)“电解”时用惰性电极,阳极的电极反应式为 。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为 。“50℃碳化”时加入过量NH4HCO3,可能的原因是:使MnSO4充分转化为MnCO3; ; 。
-
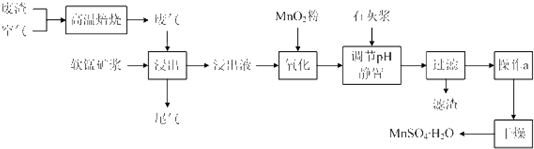
为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式:______.
(2)写出氧化过程中主要反应的离子方程式:______.
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是______.
(4)滤渣的主要成分有______.
(5)下列各组试剂中,能准确测定尾气中SO2含量的是______.(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液.
-
为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式: ________________________。
(2)写出氧化过程中主要反应的离子方程式: ______________________。
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是____________。
(4)滤渣的主要成分有_________________________________________。
(5)下列各组试剂中,能准确测定尾气中SO2含量的是__________。(填编号)
a. NaOH溶液、酚酞试液 b. 稀H2SO4酸化的KMnO4溶液
c. 碘水、淀粉溶液 d. 氨水、酚酞试液
-
碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
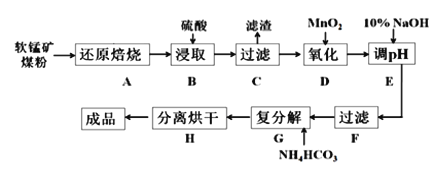
已知:还原焙烧主反应为:2MnO2+C 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为____。
(2)步骤C中得到的滤渣主要成分是______________________________,步骤D中还原剂与氧化剂的物质的量之比为_____________________________。
(3)步骤E中调节pH的范围为______________________________。
(4)步骤G的离子方程式为_________________________________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=___________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:____Mn2+ +____ S2O82- + _____H2O = __________________________________,
①请完成上述离子方程式; _____________
②请描述Mn2+未完全反应时出现的现象__________。
-
碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
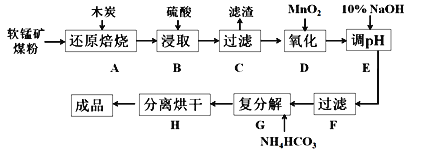
已知:还原焙烧主反应为2MnO2+C 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:

根据要求回答下列问题
(1)在实验室进行步骤A操作,需要用到的仪器名称为___________。
(2)步骤C中得到的滤渣主要成分是CaSO4和___________,步骤D中还原剂与氧化剂的物质的量之比为___________。
(3)步骤E中调节pH的范围为___________,其目的是______________________。
(4)步骤G发生的离子方程式为_________________________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=___________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为Mn2++S2O82-+H2O→H++SO42-+MnO4-,确认Mn2+离子已经完全反应的现象是___________。










