-
从人类生存环境和社会可持续发展的角度考虑,最理想的一种燃料是
A. 甲烷 B. 煤 C. 汽油 D. 氢气
难度: 简单查看答案及解析
-
热化学方程式中要注明物质状态的原因是
A. 便于判断性质 B. 物质呈现的状态跟它所含能量有关
C. 便于计算 D. 为了区别一般的化学方程式
难度: 简单查看答案及解析
-
已知C(石墨)→C(金刚石)-Q ,则可以判断
A. 金刚石比石墨稳定 B. 石墨比金刚石稳定 C. 一样稳定 D. 无法判断
难度: 简单查看答案及解析
-
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。下列叙述正确的是
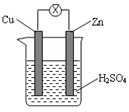
A.该装置将化学能转变为电能 B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻 D.锌片发生还原反应
难度: 简单查看答案及解析
-
黑火药是我国古代四大发明之一,下列物质中不是黑火药主要成分的是
A. 硫磺 B. 硝酸铵 C. 硝酸钾 D. 木炭
难度: 简单查看答案及解析
-
若不慎将汞温度计打碎在地面上,可在汞滴上覆盖一层物质以避免发生汞中毒,该物质是
A. 硫磺粉 B. 沙子
C. 石灰 D. 碱
难度: 简单查看答案及解析
-
在下水管道里,因某些有机物的腐败,常会产生一种有臭鸡蛋气味的有害气体,该气体是
A. CO B. CH4 C. SO3 D. H2S
难度: 简单查看答案及解析
-
下列化合物不能由单质直接化合而成的是
A. FeCl3 B. CuS C. HCl D. Fe3O4
难度: 简单查看答案及解析
-
检验SO2中是否含有CO2应采用的方法有
A. 通过石灰水 B. 通过品红溶液
C. 先通过小苏打溶液,再通过石灰水 D. 先通过足量溴水溶液,再通过石灰水
难度: 简单查看答案及解析
-
将等物质的量的SO2和Cl2同时通入紫色石蕊试液中,可观察到的现象是
A. 先褪色,后复原 B. 立即褪色 C. 仍为紫色 D. 溶液变红色
难度: 中等查看答案及解析
-
酸雨形成的主要原因是
A. 火山爆发产生的气体 B. 大气中二氧化碳含量增加
C. 乱砍乱伐森林,破坏了生态环境 D. 工业上大量燃烧含硫燃料
难度: 简单查看答案及解析
-
下列关于环境问题的说法正确的是
A. 回收废旧电池的首要原因是回收石墨 B. pH在5.6~7.0之间的降水通常称为酸雨
C. 焚烧一次性饭盒可减少白色污染 D. 燃煤时加适量的生石灰可减少二氧化硫的排放
难度: 简单查看答案及解析
-
实现下列物质间的转化,需加入还原剂的是
A. SO2→SO3 B. Na2SO3→SO2 C. SO2→S D. H2S→S
难度: 简单查看答案及解析
-
下列物质在常温下可用铁质容器盛放的是
A.亚硫酸 B.浓硫酸 C.浓盐酸 D.胆矾溶液
难度: 简单查看答案及解析
-
配制一定物质的量浓度的溶液时,要用到下列仪器中的
A.
B.
C.
D.

难度: 简单查看答案及解析
-
在容量瓶上无需标出的是
A.刻度线 B.容量标准 C.温度 D.配制溶液的浓度
难度: 简单查看答案及解析
-
下列溶液中H+的物质的量浓度最大的是
A.0.1mol/L的硫酸 B.0.1mol/L的碳酸
C.0.1mol/L的醋酸 D.0.1mol/L的盐酸
难度: 简单查看答案及解析
-
在任何条件下,纯水显中性,这是因为 ( )
A、PH=7 B、c(H+)=c(OH-)
C、c(H+)=c(OH-)=10-7mol/L D、c(H+)×c(OH-)=10-14
难度: 简单查看答案及解析
-
关于溶液的pH值,下列说法正确的是
A. pH=0的溶液呈中性 B. 某强碱溶液的浓度为0.01 mol/L,该溶液的pH值一定为12
C. 溶液pH值越大,氢离子浓度越大 D. 酸性溶液中,氢离子浓度一定大于氢氧根浓度
难度: 中等查看答案及解析
-
下列溶液的物质的量浓度不是1 mol/L的是
A. 1L溶液中含1 mol硫酸根离子的H2SO4溶液 B. 将500克胆矾溶于2升水中
C. 200mL溶液中含32克硫酸铜的溶液 D. 把125克胆矾溶于水,配成500mL溶液
难度: 中等查看答案及解析
-
100mL 0.1mol/L 硫酸铁溶液和 100mL 0.2mol/L硫酸钠溶液中,SO42-的物质的量浓度之比是
A. 1:2 B. 3:1 C. 3:2 D. 4:3
难度: 简单查看答案及解析
-
常温下,某溶液中H+的物质的量浓度是OH-的10000倍,该溶液的PH值是
A. 5 B. 8 C. 9 D. 6
难度: 简单查看答案及解析
-
配置一定体积、一定物质的量的浓度的Na2CO3溶液时,下列情况可能使溶液浓度偏低的是
A. 容量瓶内有少量蒸馏水 B. 溶液从烧杯中转移到容量瓶时,没有洗涤烧杯
C. 定容时观察液面时俯视定容 D. 配溶液的Na2CO3·10H2O晶体在空气中久置风化
难度: 中等查看答案及解析
-
实验室里需用480 mL 0.1 mol/L的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水
D.称取12.5 g胆矾配成500 mL溶液
难度: 中等查看答案及解析
-
既不能用浓硫酸干燥,又不能用碱石灰干燥的是
A. NH3 B. H2S C. SO2 D. HCl
难度: 简单查看答案及解析
-
下列俗名和化学式不吻合的是
A. 明矾 KAl(SO4)2·12H2O B. 重晶石 BaSO4
C. 熟石膏 2CaSO4·H2O D. 绿矾 CuSO4·5H2O
难度: 简单查看答案及解析
-
浓硫酸能与碳反应,是因为浓硫酸具有
A. 强酸性 B. 脱水性 C. 强氧化性 D. 吸水性
难度: 简单查看答案及解析
-
下列能够确定溶液中一定含有硫酸根的事实是
A. 取少量试液,加入盐酸酸化的氯化钡溶液,有白色沉淀生成
B. 取少量试液,加入氯化钡溶液,有白色沉淀生成,再加硝酸沉淀不消失
C. 取少量试液,加入盐酸无明显现象产生,再加入氯化钡溶液,有白色沉淀生成
D. 取少量试液,加入硝酸钡溶液,有白色沉淀生成
难度: 中等查看答案及解析
-
医疗上常用硫酸钡作X射线透视肠胃的内服药剂,俗称“钡餐”,碳酸钡却不能作“钡餐”,这是因为
A. 硫酸钡不溶于水,碳酸钡溶于水
B. 硫酸钡是强酸盐,碳酸钡是弱酸盐
C. 硫酸钡不溶于水但溶于酸,碳酸钡不溶于水也不溶于酸
D. 硫酸钡不溶于水也不溶于酸,碳酸钡不溶于水但能溶于酸
难度: 简单查看答案及解析
-
将8.4g铁粉和3.2g硫粉混合均匀,加热到反应完全为止,冷却后加足量盐酸,收集到的气体在标准状况时的体积为
A. 1.12L B. 2.24L C. 3.36L D. 4.48L
难度: 中等查看答案及解析