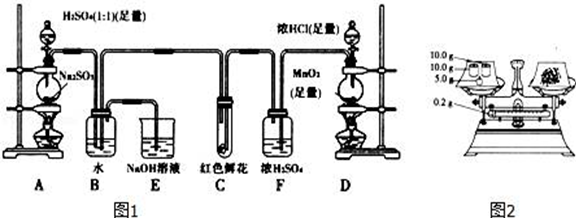
-
13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A. 13C与15N有相同的中子数 B. 13C与C60互为同素异形体
C. 15N 与14N 互为同位素 D. 15N的核外电子数与中子数相同
难度: 中等查看答案及解析
-
下列事实,不能说明氯元素的非金属性比硫元素强的是
A. 氯气与H2S能发生置换反应 B. HClO4酸性比H2SO4强
C. 盐酸是强酸,氢硫酸是弱酸 D. 受热时,氯化氢比硫化氢稳定
难度: 简单查看答案及解析
-
已知反应KClO3+ 6HCl = KCl + 3Cl2↑+ 3H2O,若用K35ClO3与H37Cl作用,下列说法中正确的是
A. Cl2相对分子质量约为73.3 B. 该反应转移电子数为6
C. KCl中只含有35Cl D. KCl中同时含有35Cl和37Cl
难度: 中等查看答案及解析
-
下列各组中每种物质都既有离子键又有共价键的一组是
A. NaOH H2SO4 (NH4)2SO4 B. MgO Na2SO4 HNO3
C. Na2O2 KOH Na3PO4 D. HCl Al2O3 MgCl2
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO2(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A. 增加C的量 B. 将容器的体积缩小一半
C. 保持体积不变,升高温度 D. 压强不变充入N2使容器体积增大
难度: 中等查看答案及解析
-
现有一定条件下进行的反应:Cu+2H2O=Cu(OH)2+H2↑,有人想根据该反应设计原电池,下列说法正确的是
A. 可以铜为负极,碳为正极,氯化钠为电解质溶液构成原电池
B. 可以铜为正极,碳为负极,氯化钠为电解质溶液构成原电池
C. 可以铜为负极,碳为正极,稀硫酸为电解质构成原电池
D. 该反应不能构成原电池
难度: 中等查看答案及解析
-
电子表电源常用微型银——锌电池,电极分别是Ag2O和Zn,电解液为KOH溶液,电极反应为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO,根据上述变化下列判断正确的是
A. Zn是负极,Ag2O是正极
B. Zn是正极,Ag2O是负极
C. 工作时电子由Ag2O极经外电路流向Zn极
D. 工作时,电池负极区溶液OH-浓度增大
难度: 困难查看答案及解析
-
巴豆酸的结构简式为CH3—CH=CH—COOH,现有①氯化氢②溴水③纯碱溶液④乙醇⑤酸性高锰酸钾溶液,根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是
A. 只有②④⑤ B. 只有①③④ C. 只有①②③⑤ D. ①②③④⑤
难度: 中等查看答案及解析
-
下列对化学知识概括合理的是
A. 酸性氧化物都是非金属氧化物
B. 一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C. 丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
D. 熔融状态能导电的物质一定是离子化合物
难度: 简单查看答案及解析
-
下列有关叙述正确的是
A. 蒸馏实验中温度计的水银球应插入溶液中
B. SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物
C. 分液时,先打开玻璃塞,再打开旋塞,使下层液体从下口流出,上层液体从上口倒出
D. 开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A. 18 g D2O和18 g H2O中含有的质子数均为10NA
B. 2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA
C. 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D. 50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 困难查看答案及解析
-
下列反应最终能生成含三价铁的化合物的是
①过量Fe与HNO3 ② 铁丝在硫蒸汽中燃烧 ③向FeBr2溶液中通入Cl2 ④铁与CuCl2溶液反应 ⑤Fe(OH)2露置于空气中
A. ①②③ B. ①③⑤ C. ③④ D. ③⑤
难度: 中等查看答案及解析
-
下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2•6H2O晶体后,仍能大量共存的是
A. Na+、H+、Cl-、NO3- B. Na+、Mg2+、Cl-、SO42-
C. K+、Ba2+、OH-、I- D. Cu2+、CO32-、Br-、ClO-
难度: 困难查看答案及解析
-
某课外实验小组设计的下列实验合理的是
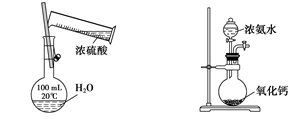
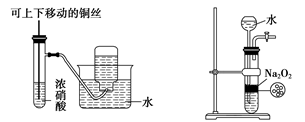
A. 配置一定浓度的硫酸 B. 制备少量氨气
C. 制备并收集少量NO2气体 D. 制备少量氧气,并随关随停
难度: 中等查看答案及解析
-
一定条件下,RO3n-和氟气(F2)可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O从而可知在RO3n-中,元素R的化合价是
A. +4 B. +5 C. +6 D. +7
难度: 中等查看答案及解析
-
将0.2mol·L-1Ba(OH)2溶液与0.05mol·L-1NaHSO4溶液等体积混合后,下列几种离子浓度大小顺序正确的是
A. c(Ba2+)>c(OH-)>c(Na+)>c(SO42-)
B. c(Na+)>c(OH-)>c(Ba2+)>c(SO42-)
C. c(Na+)>c(Ba2+)>c(OH-)>c(SO42-)
D. c(OH-)>c(Ba2+)>c(Na+)>c(SO42-)
难度: 中等查看答案及解析
-
下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是
选项
I
II
A
将少量浓氨水滴入Al2(SO4)3溶液
将少量Al2(SO4)3溶液滴入浓氨水
B
将少量SO2通入Ba(OH)2溶液
将过量SO2通入Ba(OH)2溶液
C
0.1molCl2通入含0.2molFeBr2的溶液中
0.3molCl2通入含0.2molFeBr2的溶液中
D
将过量BaCl2溶液与少量Na2SO4溶液混合
将少量Ba(OH)2溶液与过量MgSO4溶液混合
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对于某些离子的检验及结论一定正确的是
A. 向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32
B. 向某溶液中加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,则原溶液中一定有Ag+
C. 向某溶液中先加入盐酸酸化,没有明显现象,再加入BaCl2溶液,有白色沉淀产生,则原溶液中一定有SO42-
D. 向某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液一定有Ba2+
难度: 中等查看答案及解析
-
把过氧化钠投入含有HCO3-、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是
A. HCO3- B. Cl- C. Mg2+ D. Na+
难度: 简单查看答案及解析
-
将一小块铝片加人某盐酸溶液中,铝片完全溶解,在所得溶液中继续滴加NaOH溶液。生成Al(OH)3的量与加人的NaOH溶液体积的变化关系如图所示,下列说法正确的是
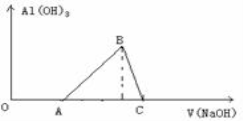
A. 盐酸与铝片反应后,盐酸还有剩余
B. 图中B点之前发生的离子反应为
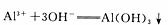
C. A→B段消耗的NaOH体积与B→C段消耗的Na0H体积比≥3:1
D. 溶解铝片的盐酸浓度与滴加的NaOH溶液浓度相等
难度: 中等查看答案及解析