-
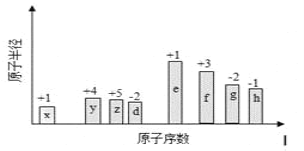
核内中子数为N 的 R2+,质量数为A,则 ng 它的同价态氧化物中所含电子物质的量为( )
A. (A+N-10)n/(A+16) mol B. (A-N+6)n/A mol
C. (A-N+2) mol D. (A-N+8)n/(A+16) mol
难度: 中等查看答案及解析
-
元素周期律和元素周期表,揭示了元素之间的内在联系,反映了元素性质与其原子结构的关系,在哲学、自然科学、生产实践各方面都有重要的意义。例如人们可以根据元素周期律,在元素周期表中金属元素与非金属元素分界线附近寻找( )
A. 耐高温的合金材料 B. 制农药的元素
C. 做催化剂的元素 D. 做半导体材料的元素
难度: 简单查看答案及解析
-
下列有关化学用语的表示方法中正确的是( )
A. 次氯酸的电子式:
B. M2+离子核外有a个电子,b 个中子,M原子符号为:
C. 用电子式表示K2O的形成过程为:
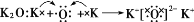
D. Na+的结构示意图:
难度: 简单查看答案及解析
-
X、Y 是第 2或第 3周期中的两种元素,它们可形成离子型化合物 XmYn,且离子均有稀有气体原子的电子结构。若X 的原子序数为 a,则Y 的原子序数不可能为( )
A. a+8-m-n B. a-8+m-n C. a+16-m-n D. a-m-n
难度: 中等查看答案及解析
-
手性分子是指在分子结构
中,当 a、b、x、y 为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子.下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
A. 木糖醇
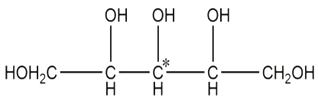 B. 丙氨酸
B. 丙氨酸C. 葡萄糖
D. 甘油醛
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 46 g NO2 和N2O4 混合气体中的氧原子数为 2NA
B. 1 mol N2 与 4 mol H2 反应生成的 NH3 分子数为 2NA
C. 1 mol Fe 和 1 mol Cl2 充分反应,电子转移数为 3NA
D. 标准状况下,2.24 LCCl4 含有的共价键数为 0.4NA
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W 的原子半径依次增大,X 是短周期元素中原子半径最小的,Z、W 同主族,且 Z、W 的原子序数之差与Y 的原子序数相同,X、Y、Z、W 的最外层电子数之和为 15。下列说法正确的是( )
A. Z 单质与 WY2 在高温条件下反应生成 W 单质,说明非金属性:Z>W
B. 向无色的X2Z2Y4 溶液中滴加少量酸性高锰酸钾溶液,溶液仍为无色,体现了X2Z2Y4 的还原性
C. Y、Z、W 的简单氢化物的稳定性依次增强
D. 由X、Y 两种元素形成的所有化合物中所含化学键的类型完全相同
难度: 中等查看答案及解析
-
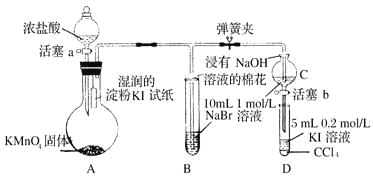
实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
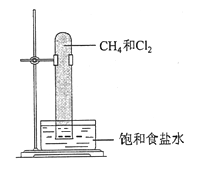
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是
A.
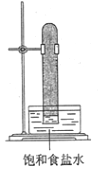 B.
B. 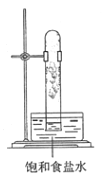 C.
C. 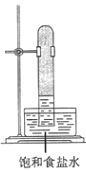 D.
D. 
难度: 简单查看答案及解析
-
固体A 的化学式为 NH5,已知其熔融态能够导电,则下列有关说法不正确的是( )
A. 1 mol NH5 中含有 5 NA 个 N—H 键(设 NA 表示阿伏加德罗常数的值)
B. NH5 中既有共价键又有离子键
C. NH5 的电子式为
D. NH5 与水反应的离子方程式为NH4++H-+H2O===NH3·H2O+H2↑
难度: 中等查看答案及解析
-
下列关于ⅡA 族元素性质预测正确的是( )
A. Ra(OH)2 和 Mg(OH)2 类似,二者均难溶于水
B. RaSO4 和BaSO4 类似,二者均难溶于水
C. Sr在常温下不能和冷水反应
D. 依据对角线规则,Be 的性质和Al 类似,Be(OH)2 和NaOH 反应可生成NaBeO2
难度: 中等查看答案及解析
-
标准状况下,某同学向 100 mLH2S 饱和溶液中通入 SO2,所得溶液 pH 变化如图所示,下列分析中, 正确的是( )
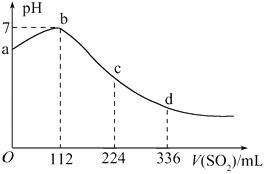
A. 亚硫酸是比氢硫酸更弱的酸
B. ab 段反应是:SO2+2H2S===3S↓+2H2O
C. 原 H2S 溶液的物质的量浓度为 0.05mol/L
D. b 点对应的溶液导电性最强
难度: 中等查看答案及解析
-
已知草酸晶体(H2C2O4·2H2O)的熔点为 101℃,170℃分解。下列选用的装置和药品能达到实验目的的是( )
A
B
C
D
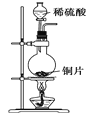
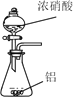
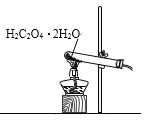
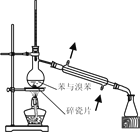
制取SO2
制取NO2
H2C2O4·2H2O分解
分离苯与溴苯
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期元素 X、Y、Z、W、R、T 的原子序数依次增大, X 的最外层电子数与次外层电子数相等, X、W位于同族。Y 和 Z 的价电子数之和等于 R 和T 的最外层电子数之和,这四种元素组成两种盐 Z2TY3 和ZRY2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是( )
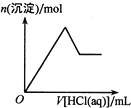
A. 简单离子的半径:r(Y)<r(Z)<r(W)
B. 气 态 氢 化 物 的 热 稳 定 性 :T>Y
C. 工业上电解R 的氯化物冶炼单质 R
D. X的氢氧化物既可与强酸反应,又可与强碱反应
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W 原子序数依次增大,且 X、Z 同主族,Y 为金属元素,且Y 的原子序数小于X 和 Z 的最外层电子数之和,Z 原子的最外层电子数与核外电子总数之比为 3∶8。下列说法正确的是( )
A. 原子半径:r(W)>r(Y)>r(X)
B. X与Y 组成的化合物中均不含共价键
C. Z 的简单气态氢化物的热稳定性比W的强
D. 元素Y、W 形成的化合物的水溶液呈中性
难度: 中等查看答案及解析
-
下列实验能达到相应实验目的的是( )
选项
试剂
实验目的
实验装置
X
Y
Z
A
Na2SO3
稀 HNO3
品红溶液
证明 SO2 具有漂白性
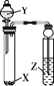
B
MnO2
浓盐酸
KI-淀粉溶液
比较Cl2 与 I2 的氧化性强弱
C
Na2CO3
醋酸
Na2SiO3 溶液
证明酸性:
CH3COOH > H2CO3 >H2SiO3
D
蔗糖
浓硫酸
溴水
证明浓硫酸具有脱水性、氧化性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在一定量铁的氧化物中,加入 45mL 4 mol/L 硫酸溶液恰好完全反应,所得溶液中 Fe2+能恰好被标准状况下 672 mL 氯气氧化。则该固体中氧原子和铁原子的个数之比为( )
A. 6:5 B. 3:2 C. 9:7 D. 4:3
难度: 中等查看答案及解析