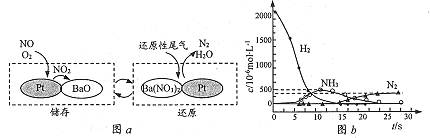
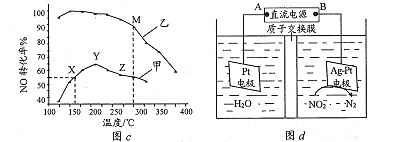
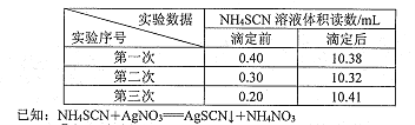
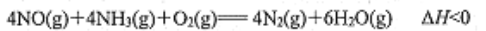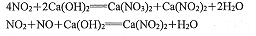-
每年3月22日为“世界水日”。下列有关“废水”的处理正确的是
A. 工业废水无需处理,直接用于农业灌溉
B. 废水经氯气消毒后,即可安全再利用
C. 寻找方式来减少和再利用废水可节约水资源
D. 收集和处理废水,弊大于利
难度: 简单查看答案及解析
-
下列有关化学用语的表示,正确的是
A. 氨基(-NH2)的电子式:
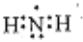
B. 钾离子的结构示意图:
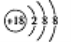
C. 二氧化碳分子的比例模型:
D. 碳酸电离的方程式:
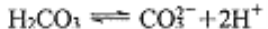
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. 晶体硅熔点高硬度大,可用于制造半导体材料
B. 碳酸钠溶液显碱性,可用于除去金属器件表面的油脂
C. 碳酸氢钠能与碱反应,可用作焙制糕点的膨松剂
D. 明矾溶于水能形成胶体,可用于自来水的杀菌消毒
难度: 简单查看答案及解析
-
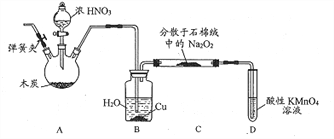
实验室制取氨气、收集、验证其还原性并进行尾气处理的装置和原理能达到实验目的的是
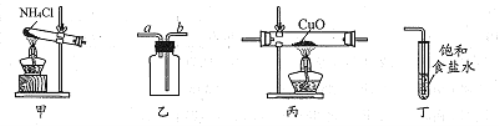
A. 用装置甲制取氨气
B. 用装置乙收集氨气时气体应该从a口进b口出
C. 装置丙中黑色固体变成红色时还原产物一定为铜
D. 可以用装置丁吸收氨气,进行尾气处理
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,其中X、Y处于同一周期且相邻,Z元素的原子在短周期中原子半径最大,W是地壳中含量最多的金属元素。下列说法正确的是
A. 原子半径:r(X)<r(Y)<r(W)<r(Z)
B. Z和X组成的化合物中一定不含共价键
C. W的单质还原性比Z的强
D. Y、Z、W三种元素组成的化合物可能是Z3WY6
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 石灰水中加入过量小苏打溶液:
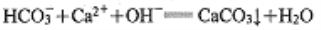
B. 将铜丝插入足量浓硝酸中:

C. 将SO2通入少量氨水中:
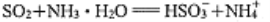
D. 用双氧水从酸化的海带灰浸出液中提取碘:

难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是
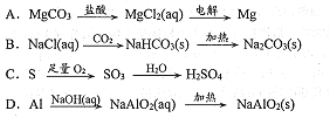
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
电石(主要成分为CaC2)是重要的基本化工原料。己知2000℃时,电石生产原理如下:
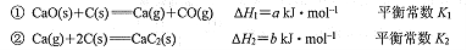
以下说法不正确的是
A. 反应①
B. 反应
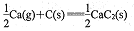 平衡常数K=
平衡常数K=C. 2000℃时增大压强,K1减小,K2增大
D. 反应

难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.
的溶液中:

B. 通入大量CO2的溶液中:
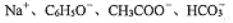
C. c(ClO-)=l.0 mol/ L的溶液中:
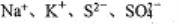
D. 能使酚酞变红的溶液中:
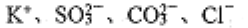
难度: 中等查看答案及解析
-
工业上用丁烷催化脱氢侧备丁烯:C4H10(g)
CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
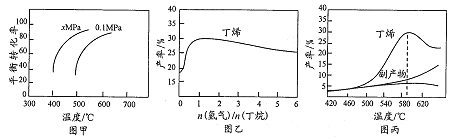
A. 由图甲可知,x小于0.1
B. 由图乙可知,丁烯产率先增大后减小,减小的原因是氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速 率减小
C. 由图丙可知产率在590℃之前随温度升高面增大的原因可能是溫度升高平衡正向移动
D. 由图丙可知,丁烯产率在590℃之后快速降低的主要原因为丁烯高温分解生成副产物
难度: 困难查看答案及解析
-
下列叙述中不正确的是
A. 以铁作阳极,铂作阴极,电解饱和食盐水,可以制备烧碱
B. 25℃下,在NH3·H2O稀溶液中加水稀释,
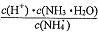 的值不变
的值不变C. 工业生产硫酸时,接触室催化氧化S02时使用热交换器可以充分利用热量,降低生产成本
D. 反应
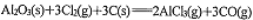 室温下不能自发进行,则△H>0
室温下不能自发进行,则△H>0难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一定温度下(T2> Tl),在3个体积均为2.0 L的恒容密闭容器中反应 2NO(g)+ Cl2(g) = 2ClNO(g)(正反应放热)达到平衡,下列说法正确的是
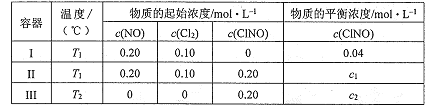
A. 达到平衡时,容器I与容器II中的总压强之比为1:2
B. 达到平衡时,容器III中ClNO的转化率小于80%
C. 达到平衡时,容器II中c(ClNO(/ c(NO)比容器I中的大
D. 若温度为Tl,起始时向同体积恒容密闭容器中充入0.20 mol NO(g)、0.2 mol Cl2(g)和0.20 mol ClNO(g),则该反应向正反应方向进行
难度: 困难查看答案及解析
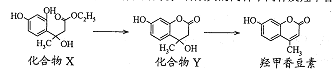
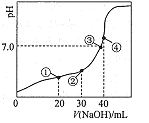
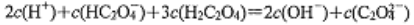
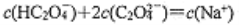
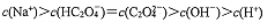

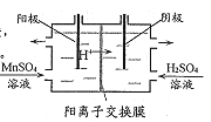
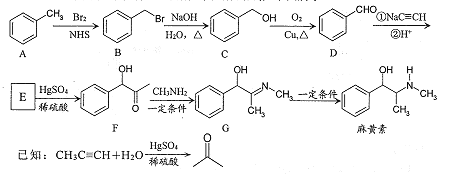

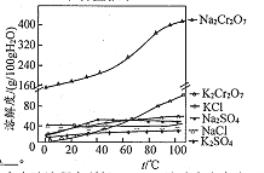
 ____________
____________